Постоянная Больцмана: значение и физический смысл. Постоянная больцмана
Согласно закону Стефана – Больцмана плотность интегрального полусферического излучения E 0 зависит только от температуры и изменяется пропорционально четвертой степени абсолютной температуры T :
Стефана – Больцмана постоянная σ 0 – физическая постоянная, входящая в закон, определяющий объемную плотность равновесного теплового излучения абсолютно черного тела:
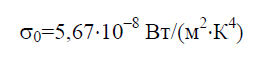
Исторически закон Стефана-Больцмана был сформулирован раньше закона излучения Планка, из которого он вытекает как следствие. Закон Планка устанавливает зависимость спектральной плотности потока излучения E 0 от длины волны λ и температуры T :

где λ – длина волны, м; с
=2,998 10 8 м/с – скорость
света в вакууме; Т
– температура тела, К;
h
= 6,625 ×10 -34 Дж×с– постоянная Планка.
Физическая постоянная k , равная отношению универсальной газовой постоянной R =8314Дж/(кг× K) к числу Авогадро NA =6,022× 10 26 1/(кг× моль):

Число различных конфигураций системы из N частиц для данного набора чисел n i (число частиц, находящихся в i -том состоянии, которому соответствует энергия e i ) пропорционально величине:

Величина W есть число способов распределения N частиц по энергетическим уровням. Если справедливо соотношение (6) то считается, что исходная система подчиняется статистике Больцмана. Набор чисел n i , при котором число W максимально, встречается наиболее часто и соответствует наиболее вероятному распределению.
Физическая кинетика – микроскопическая теория процессов в статистически неравновесных системах.
Описание большого числа частиц может успешно осуществляться вероятностными методами. Для одноатомного газа состояние совокупности молекул определяется их координатами и значениями проекций скоростей на соответствующие координатные оси. Математически это описывается функцией распределения, характеризующей вероятность пребывания частицы в данном состоянии:

есть ожидаемое число молекул в объеме d d , координаты которых находятся в интервале от до +d , а скорости в интервале от до +d.
Если осредненной по времени потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией, то газ называется идеальным. Идеальный газ называется газом Больцмана, если отношение длины пробега молекул в этом газе к характерному размеру течения L конечно, т.е.

т.к. длина пробега обратно пропорциональна nd 2 (n – числовая плотность 1/м 3 , d – диаметр молекулы, м).
Величину

называют H -функцией Больцмана для единицы объема, которая связана с вероятностью обнаружения системы из молекул газа в данном состоянии. Каждому состоянию соответствуют определенные числа заполнения шестимерных пространственно-скоростных ячеек, на которые может быть разбито фазовое пространство рассматриваемых молекул. Обозначим W вероятность того, что в первой ячейке рассматриваемого пространства окажется N 1 молекул, во второй N 2 и т.д.
С точностью до постоянной, определяющей начало отсчета вероятности, правомерно соотношение:
 ,
,
где  – H-функция области
пространства А
, занятой газом. Из (9) видно, что W
и H
взаимосвязаны, т.е. изменение вероятности состояния приводит к соответствующей
эволюции H функции.
– H-функция области
пространства А
, занятой газом. Из (9) видно, что W
и H
взаимосвязаны, т.е. изменение вероятности состояния приводит к соответствующей
эволюции H функции.

Больцмана принцип устанавливает связь между энтропией S физической системы и термодинамической вероятностью W её состояния:

(печатается по изданию: Коган М.Н. Динамика разреженного газа. – М.: Наука, 1967.)
Общий вид КУБ:

где – массовая сила, обусловленная наличием различных полей (гравитационного, электрического, магнитного), действующая на молекулу; J – интеграл столкновений. Именно этот член уравнения Больцмана учитывает столкновения молекул друг с другом и соответствующие изменения скоростей взаимодействующих частиц. Интеграл столкновений представляет собой пятимерный интеграл и имеет следующую структуру:

Уравнение (12) с интегралом (13) получено для столкновения молекул, при которых не возникает тангенциальных сил, т.е. сталкивающиеся частицы считаются идеально гладкими.
В процессе
взаимодействия внутренняя энергия молекул не меняется, т.е. предполагается, что
эти молекулы являются идеально упругими. Рассматриваются две группы молекул,
имеющих до соударения друг с другом (столкновения) скорости и (рис. 1), а после
столкновения соответственно скорости и . Разность скоростей и называется
относительной скоростью, т.е. . Ясно, что для гладкого упругого
столкновения .
Функции распределения f 1 ", f", f 1 ,f
описывают
молекулы соответствующих групп после и до столкновений, т.е. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Рис. 1. Столкновение двух молекул.
В (13) входят два параметра, характеризующие расположение сталкивающихся молекул друг относительно друга: b и ε; b – прицельное расстояние, т.е. наименьшее расстояние, на которое сблизились бы молекулы при отсутствии взаимодействия (рис. 2); ε называют угловым параметром столкновений (рис. 3). Интегрирование по b от 0 до ¥ и по от 0 до 2p (два внешних интеграла в (12)) охватывает всю плоскость силового взаимодействия перпендикулярно вектору

Рис. 2. Траектория движения молекул.

Рис. 3. Рассмотрение взаимодействия молекул в цилиндрической системе координат: z , b , ε
Кинетическое уравнение Больцмана выведено при следующих допущениях и предположениях.
1. Считается, что происходит в основном столкновения двух молекул, т.е. роль столкновений одновременно трех и большего числа молекул незначительна. Это допущение позволяет использовать для анализа одночастичную функцию распределения, которая выше названа просто функцией распределения. Учет столкновения трех молекул приводит к необходимости использования в исследовании двухчастичной функции распределения. Соответственно анализ существенно усложняется.
2. Предположение о молекулярном хаосе. Оно выражается в том, что вероятности обнаружения частицы 1 в фазовой точке и частицы 2 в фазовой точке независимы друг от друга.
3.
Равновероятны столкновения молекул с любым прицельным расстоянием, т.е. функция
распределения не меняется на диаметре взаимодействия. Необходимо отметить, что
анализируемый элемент должен быть малым, чтобы f
в пределах этого элемента не менялась, но в то же время
чтобы
не была велика относительная флуктуация ~
. Потенциалы
взаимодействия, используемые при вычислении интеграла столкновений, являются
сферически симметричными, т.е. ![]() .
.
Распределение Максвелла-Больцмана
Равновесное состояние газа описывается абсолютным Максвелловским распределением, которое является точным решением кинетического уравнения Больцмана:

где m – масса молекулы, кг.
Общее локально-максвелловское распределение иначе называемое распределение Максвелла-Больцмана:

в том случае, когда газ движется
как целое со скоростью и переменные n
,
T
зависят от координаты
и времени t
.
В поле тяготения Земли точное решение уравнения Больцмана показывает:

где n 0 = плотность у поверхности Земли, 1/м 3 ; g – ускорение силы тяжести, м/с 2 ; h – высота, м. Формула (16) является точным решением кинетического уравнения Больцман либо в безграничном пространстве, либо при наличии границ, не нарушающих этого распределения, при этом температура также должна оставаться постоянной.
Эта страница оформлена Пузиной Ю.Ю. при поддержке Российского Фонда Фундаментальных Исследований – проект №08-08-00638.
Постоя́нная Бо́льцмана ( или ) - физическая постоянная , определяющая связь между температурой и энергией . Названа в честь австрийского физика Людвига Больцмана , сделавшего большой вклад в статистическую физику , в которой эта постоянная играет ключевую роль. Её экспериментальное значение в Международной системе единиц (СИ) равно:
Дж / .
Числа в круглых скобках указывают стандартную погрешность в последних цифрах значения величины. В естественной системе единиц Планка естественная единица температуры задаётся так, что постоянная Больцмана равна единице.
Связь между температурой и энергией
В однородном идеальном газе , находящемся при абсолютной температуре , энергия, приходящаяся на каждую поступательную степень свободы , равна, как следует из распределения Максвелла , . При комнатной температуре (300 ) эта энергия составляет Дж , или 0,013 эВ . В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в .
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона . В случае молекулярного газа ситуация усложняется, например, двухатомный газ имеет пять степеней свободы (при низких температурах, когда не возбуждены колебания атомов в молекуле).
Определение энтропии
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
Коэффициент пропорциональности и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими () и макроскопическими состояниями (), выражает центральную идею статистической механики.
Предполагаемая фиксация значения
XXIV Генеральная конференция по мерам и весам , состоявшаяся 17-21 октября 2011 года, приняла резолюцию , в которой, в частности, предложено будущую ревизию Международной системы единиц произвести так, чтобы зафиксировать значение постоянной Больцмана, после чего она будет считаться определённой точно . В результате будет выполняться точное равенство k =1,380 6X·10 −23 Дж/К . Такая предполагаемая фиксация связана со стремлением переопределить единицу термодинамической температуры кельвин , связав его величину со значением постоянной Больцмана.
См. также
Напишите отзыв о статье "Постоянная Больцмана"
Примечания
| Это заготовка статьи по термодинамике и статистической физике . Вы можете помочь проекту, дополнив её. |
Отрывок, характеризующий Постоянная Больцмана
– Но что же это значит? – задумчиво сказала Наташа.– Ах, я не знаю, как все это необычайно! – сказала Соня, хватаясь за голову.
Через несколько минут князь Андрей позвонил, и Наташа вошла к нему; а Соня, испытывая редко испытанное ею волнение и умиление, осталась у окна, обдумывая всю необычайность случившегося.
В этот день был случай отправить письма в армию, и графиня писала письмо сыну.
– Соня, – сказала графиня, поднимая голову от письма, когда племянница проходила мимо нее. – Соня, ты не напишешь Николеньке? – сказала графиня тихим, дрогнувшим голосом, и во взгляде ее усталых, смотревших через очки глаз Соня прочла все, что разумела графиня этими словами. В этом взгляде выражались и мольба, и страх отказа, и стыд за то, что надо было просить, и готовность на непримиримую ненависть в случае отказа.
Соня подошла к графине и, став на колени, поцеловала ее руку.
– Я напишу, maman, – сказала она.
Соня была размягчена, взволнована и умилена всем тем, что происходило в этот день, в особенности тем таинственным совершением гаданья, которое она сейчас видела. Теперь, когда она знала, что по случаю возобновления отношений Наташи с князем Андреем Николай не мог жениться на княжне Марье, она с радостью почувствовала возвращение того настроения самопожертвования, в котором она любила и привыкла жить. И со слезами на глазах и с радостью сознания совершения великодушного поступка она, несколько раз прерываясь от слез, которые отуманивали ее бархатные черные глаза, написала то трогательное письмо, получение которого так поразило Николая.
На гауптвахте, куда был отведен Пьер, офицер и солдаты, взявшие его, обращались с ним враждебно, но вместе с тем и уважительно. Еще чувствовалось в их отношении к нему и сомнение о том, кто он такой (не очень ли важный человек), и враждебность вследствие еще свежей их личной борьбы с ним.
Но когда, в утро другого дня, пришла смена, то Пьер почувствовал, что для нового караула – для офицеров и солдат – он уже не имел того смысла, который имел для тех, которые его взяли. И действительно, в этом большом, толстом человеке в мужицком кафтане караульные другого дня уже не видели того живого человека, который так отчаянно дрался с мародером и с конвойными солдатами и сказал торжественную фразу о спасении ребенка, а видели только семнадцатого из содержащихся зачем то, по приказанию высшего начальства, взятых русских. Ежели и было что нибудь особенное в Пьере, то только его неробкий, сосредоточенно задумчивый вид и французский язык, на котором он, удивительно для французов, хорошо изъяснялся. Несмотря на то, в тот же день Пьера соединили с другими взятыми подозрительными, так как отдельная комната, которую он занимал, понадобилась офицеру.
Все русские, содержавшиеся с Пьером, были люди самого низкого звания. И все они, узнав в Пьере барина, чуждались его, тем более что он говорил по французски. Пьер с грустью слышал над собою насмешки.
На другой день вечером Пьер узнал, что все эти содержащиеся (и, вероятно, он в том же числе) должны были быть судимы за поджигательство. На третий день Пьера водили с другими в какой то дом, где сидели французский генерал с белыми усами, два полковника и другие французы с шарфами на руках. Пьеру, наравне с другими, делали с той, мнимо превышающею человеческие слабости, точностью и определительностью, с которой обыкновенно обращаются с подсудимыми, вопросы о том, кто он? где он был? с какою целью? и т. п.
Вопросы эти, оставляя в стороне сущность жизненного дела и исключая возможность раскрытия этой сущности, как и все вопросы, делаемые на судах, имели целью только подставление того желобка, по которому судящие желали, чтобы потекли ответы подсудимого и привели его к желаемой цели, то есть к обвинению. Как только он начинал говорить что нибудь такое, что не удовлетворяло цели обвинения, так принимали желобок, и вода могла течь куда ей угодно. Кроме того, Пьер испытал то же, что во всех судах испытывает подсудимый: недоумение, для чего делали ему все эти вопросы. Ему чувствовалось, что только из снисходительности или как бы из учтивости употреблялась эта уловка подставляемого желобка. Он знал, что находился во власти этих людей, что только власть привела его сюда, что только власть давала им право требовать ответы на вопросы, что единственная цель этого собрания состояла в том, чтоб обвинить его. И поэтому, так как была власть и было желание обвинить, то не нужно было и уловки вопросов и суда. Очевидно было, что все ответы должны были привести к виновности. На вопрос, что он делал, когда его взяли, Пьер отвечал с некоторою трагичностью, что он нес к родителям ребенка, qu"il avait sauve des flammes [которого он спас из пламени]. – Для чего он дрался с мародером? Пьер отвечал, что он защищал женщину, что защита оскорбляемой женщины есть обязанность каждого человека, что… Его остановили: это не шло к делу. Для чего он был на дворе загоревшегося дома, на котором его видели свидетели? Он отвечал, что шел посмотреть, что делалось в Москве. Его опять остановили: у него не спрашивали, куда он шел, а для чего он находился подле пожара? Кто он? повторили ему первый вопрос, на который он сказал, что не хочет отвечать. Опять он отвечал, что не может сказать этого.
Постоя́нная Бо́льцмана ( k {\displaystyle k} или k B {\displaystyle k_{\rm {B}}} ) - физическая постоянная , определяющая связь между температурой и энергией . Названа в честь австрийского физика Людвига Больцмана , сделавшего большой вклад в статистическую физику , в которой эта постоянная играет ключевую роль. Её значение в Международной системе единиц СИ согласно изменения определений основных единиц СИ (2018) точно равно
k = 1,380 649 × 10 − 23 {\displaystyle k=1{,}380\,649\times 10^{-23}} Дж / .Связь между температурой и энергией
В однородном идеальном газе , находящемся при абсолютной температуре T {\displaystyle T} , энергия, приходящаяся на каждую поступательную степень свободы , равна, как следует из распределения Максвелла , k T / 2 {\displaystyle kT/2} . При комнатной температуре (300 ) эта энергия составляет 2 , 07 × 10 − 21 {\displaystyle 2{,}07\times 10^{-21}} Дж , или 0,013 эВ . В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в 3 2 k T {\displaystyle {\frac {3}{2}}kT} .
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона . В случае молекулярного газа ситуация усложняется, например, двухатомный газ имеет 5 степеней свободы - 3 поступательных и 2 вращательных (при низких температурах, когда не возбуждены колебания атомов в молекуле и не добавляются дополнительные степени свободы).
Определение энтропии
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний Z {\displaystyle Z} , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
S = k ln Z . {\displaystyle S=k\ln Z.}Коэффициент пропорциональности k {\displaystyle k} и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими ( Z {\displaystyle Z} ) и макроскопическими состояниями ( S {\displaystyle S} ), выражает центральную идею статистической механики.
Физический смысл: Газовая постоянна я численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К
В системе СГС Газовая постоянная равна:
Удельная Газовая постоянная равна:
В формуле мы использовали:
Универсальная газовая постоянная (постоянная Менделеева)
Постоянная Больцмана
Число Авогадро
Закон Авогадро - В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Из Закона Авогадро выводится 2 следствия:
Следствие 1 : Один моль любого газа при одинаковых условиях занимает одинаковый объем
В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона
1) Закон Шарля:
2) Закон Гей-Люссака:
3) Закон Боля-Мариотта:
Следствие 2 : Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов
Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
В Формуле мы использовали:
Относительная плотность газа
Молярные массы
Давление
Молярный объем
Универсальная газовая постоянная
Абсолютная температу
Закон Бойля Мариотта - При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
Это означает, что с ростом давления на газ его объем уменьшается, и наоборот. Для неизменного количества газа закон Бойля - Мариотта можно также интерпретировать следующим образом: при неизменной температуре произведение давления на объем является величиной постоянной. Закон Бойля - Мариотта выполняется строго для идеального газа и является следствием уравнения Менделеева Клапейрона. Для реальных газов закон Бойля - Мариотта выполняется приближенно. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах.
Чтобы было легче понять Закон Бойля Мариотта представим, что вы сдавливаете надутый воздушный шарик. Поскольку свободного пространства между молекулами воздуха достаточно, вы без особого труда, приложив некоторую силу и проделав определенную работу, сожмете шарик, уменьшив объем газа внутри него. Это одно из основных отличий газа от жидкости. В шарике с жидкой водой, например, молекулы упакованы плотно, как если бы шарик был заполнен микроскопическими дробинками. Поэтому вода не поддается, в отличие от воздуха, упругому сжатию.
Так же есть:
Закон Шарля:
Закон Гей Люссака:
В законе мы использовали:
Давление в 1 сосуде
Объем 1 сосуда
Давление во 2 сосуде
Объем 2 сосуда
Закон Гей Люссака - при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре
Объем V данной массы газа при постоянном давлении газа прямо пропорционален изменению температуры
Закон Гей-Люссака справедлив только для идеальных газов, реальные газы подчиняются ему при температурах и давлениях, далеких от критических значений. Является частным случаем уравнения Клайперона.
Так же есть:
Уравнение Менделеева Клапейрона:
Закон Шарля:
Закон Бойля Мариотта:
В законе мы использовали:
Объем в 1 сосуде
Температура в 1 сосуде
Объем во 1 сосуде
Температура в 1 сосуде
Начальный объем газа
Объем газа при температуре T
Коэффициент теплового расширения газов
Разность начальной и конечной температур
Закон Генри - закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон Генри описывает процесс растворения газа в жидкости. Что представляет собой жидкость, в которой растворен газ, мы знаем на примере газированных напитков - безалкогольных, слабоалкогольных, а по большим праздникам - шампанского. Во всех этих напитках растворена двуокись углерода (химическая формула CO2) - безвредный газ, используемый в пищевой промышленности по причине его хорошей растворимости в воде, а пенятся после открытия бутылки или банки все эти напитки по той причине, что растворенный газ начинает выделяться из жидкости в атмосферу, поскольку после открытия герметичного сосуда давление внутри падает.
Собственно, закон Генри констатирует достаточно простой факт: чем выше давление газа над поверхностью жидкости, тем труднее растворенному в ней газу высвободиться. И это совершенно логично с точки зрения молекулярно-кинетической теории, поскольку молекуле газа, чтобы вырваться на свободу с поверхности жидкости, нужно преодолеть энергию соударений с молекулами газа над поверхностью, а чем выше давление и, как следствие, число молекул в приграничной области, тем сложнее растворенной молекуле преодолеть этот барьер.
В формуле мы использовали:
Концентрация газа в растворе в долях моля
Коэффициент Генри
Парциальное давление газа над раствором
Закон излучения Кирхгофа - отношение испускательной и поглощательной способностей не зависит от природы тела, оно является для всех тел одной и той же.
По определению, абсолютно чёрное тело поглощает всё падающее на него излучение, то есть для него (Поглощательная способность тела) . Поэтому функция совпадает с испускательной способностью
В формуле мы использовали:
Испускательная способность тела
Поглощательная способность тела
Функция Кирхгофа
Закон Стефана-Больцмана - Энергетическая светимость абсолютно черного тела пропорциональна четвертой степени абсолютной температуры.
Из формулы видно, что при повышении температуры светимость тела не просто возрастает - она возрастает в значительно большей степени. Увеличьте температуру вдвое, и светимость возрастет в 16 раз!
Нагретые тела излучают энергию в виде электромагнитных волн различной длины. Когда мы говорим, что тело «раскалено докрасна», это значит, что его температура достаточно высока, чтобы тепловое излучение происходило в видимой, световой части спектра. На атомарном уровне излучение становится следствием испускания фотонов возбужденными атомами.
Чтобы понять, как действует этот закон, представьте себе атом, излучающий свет в недрах Солнца. Свет тут же поглощается другим атомом, излучается им повторно - и таким образом передается по цепочке от атома к атому, благодаря чему вся система находится в состоянии энергетического равновесия . В равновесном состоянии свет строго определенной частоты поглощается одним атомом в одном месте одновременно с испусканием света той же частоты другим атомом в другом месте. В результате интенсивность света каждой длины волны спектра остается неизменной.
Температура внутри Солнца падает по мере удаления от его центра. Поэтому, по мере движения по направлению к поверхности, спектр светового излучения оказывается соответствующим более высоким температурам, чем температура окружающий среды. В результате, при повторном излучении, согласно закону Стефана-Больцмана , оно будет происходить на более низких энергиях и частотах, но при этом, в силу закона сохранения энергии, будет излучаться большее число фотонов. Таким образом, к моменту достижения им поверхности спектральное распределение будет соответствовать температуре поверхности Солнца (около 5 800 К), а не температуре в центре Солнца (около 15 000 000 К).
Энергия, поступившая к поверхности Солнца (или к поверхности любого горячего объекта), покидает его в виде излучения. Закон Стефана-Больцмана как раз и говорит нам, какова излученная энергия.
В вышеприведенной формулировке закон Стефана-Больцмана распространяется только на абсолютно черное тело, поглощающее всё попадающее на его поверхность излучение. Реальные физические тела поглощают лишь часть лучевой энергии, а оставшаяся часть ими отражается, однако закономерность, согласно которой удельная мощность излучения с их поверхности пропорциональна Т в 4, как правило, сохраняется и в этом случае, однако постоянную Больцмана в этом случае приходится заменять на другой коэффициент, который будет отражать свойства реального физического тела. Такие константы обычно определяются экспериментальным путем.
В формуле мы использовали:
Энергетическая светимость тела
Постоянная Стефана-Больцмана
Абсолютная температура
Закон Шарля - давление данной массы идеального газа при постоянном объеме прямо пропорционально абсолютной температуре
Чтобы легче было понять закон Шарля , представьте себе воздух внутри воздушного шарика. При постоянной температуре воздух в шарике будет расширяться или сжиматься, пока давление, производимое его молекулами, не достигнет 101 325 паскалей и не сравняется с атмосферным давлением. Иными словами, пока на каждый удар молекулы воздуха извне, направленный внутрь шарика, не будет приходиться аналогичный удар молекулы воздуха, направленный изнутри шарика вовне.
Если понизить температуру воздуха в шарике (например, положив его в большой холодильник), молекулы внутри шарика станут двигаться медленнее, менее энергично ударяя изнутри о стенки шарика. Молекулы наружного воздуха тогда будут сильнее давить на шарик, сжимая его, в результате объем газа внутри шарика будет уменьшаться. Это будет происходить до тех пор, пока увеличение плотности газа не компенсирует понизившуюся температуру, и тогда опять установится равновесие.
Так же есть:
Уравнение Менделеева Клапейрона:
Закон Гей Люссака:
Закон Бойля Мариотта:
В законе мы использовали:
Давление в 1 сосуде
Температура в 1 сосуде
Давление в 2 сосуде
Температура в 2 сосуде
Первый закон термодинамики - Изменение внутренней энергии ΔU не изолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A внешних сил
Вместо работы А, совершаемой внешними силами над термодинамической системой, часто удобнее бывает рассматривать работу A’, совершаемую термодинамической системой над внешними телами. Так как эти работы равны по абсолютному значению, но противоположны по знаку:
Тогда после такого преобразования первый закон термодинамики будет иметь вид:
Первый закон термодинамики - В не изолированной термодинамической системе изменение внутренней энергии равно разности между полученным количеством теплоты Q и работой A’, совершаемой данной системой
Говоря простым языком первый закон термодинамики говорит о энергии, которая не может сама создаваться и исчезать в никуда, она передается от одной системы к другой и превращается из одной формы в другую (механическая в тепловую).
Важным следствием первого закона термодинамики является то, что невозможности создать машину (двигатель), которая способна совершать полезную работу без потребления энергии извне. Такая гипотетическая машина получила название вечного двигателя первого рода.
Названа в честь австрийского физика Людвига Больцмана , сделавшего большой вклад в статистическую физику , в которой эта постоянная играет ключевую роль. Её экспериментальное значение в системе СИ равно
Дж / .Числа в круглых скобках указывают стандартную погрешность в последних цифрах значения величины. В принципе, постоянная Больцмана может быть получена из определения абсолютной температуры и других физических постоянных. Однако, вычисление постоянной Больцмана с помощью основных принципов слишком сложно и невыполнимо при современном уровне знаний. В естественной системе единиц Планка естественная единица температуры задаётся так, что постоянная Больцмана равна единице.
Связь между температурой и энергией
В однородном идеальном газе , находящемся при абсолютной температуре T
, энергия, приходящаяся на каждую поступательную степень свободы , равна, как следует из распределения Максвелла k
T
/ 2
. При комнатной температуре (300 ) эта энергия составляет ![]() Дж , или 0,013 эВ . В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в 3 / 2(k
T
)
.
Дж , или 0,013 эВ . В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в 3 / 2(k
T
)
.
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона. В случае молекулярного газа ситуация усложняется, например двухатомный газ уже имеет приблизительно пять степеней свободы.
Определение энтропии
Энтропия термодинамической системы определяется как натуральный логарифм от числа различных микросостояний Z , соответствующих данному макроскопическому состоянию (например, состоянию с заданной полной энергией).
S = k lnZ .Коэффициент пропорциональности k и есть постоянная Больцмана. Это выражение, определяющее связь между микроскопическими (Z ) и макроскопическими состояниями (S ), выражает центральную идею статистической механики.
См. также
Wikimedia Foundation . 2010 .
Смотреть что такое "Больцмана постоянная" в других словарях:
Физическая постоянная k, равная отношению универсальной газовой постоянной R к числу Авогадро NA: k = R/NA = 1,3807.10 23 Дж/К. Названа по имени Л. Больцмана … Большой Энциклопедический словарь
Одна из фундаментальных физических констант; равна отношению газовой постоянной R к Авогадро постоянной NA, обозначается k; названа в честь австр. физика Л. Больцмана (L. Boltzmann). Б. п. входит в ряд важнейших соотношений физики: в ур ние… … Физическая энциклопедия
БОЛЬЦМАНА ПОСТОЯННАЯ - (k) универсальная физ. постоянная, равная отношению универсальной газовой (см.) к постоянной Авогадро NA: k = R/Na = (1,380658 ± 000012)∙10 23 Дж/К … Большая политехническая энциклопедия
Физическая постоянная k, равная отношению универсальной газовой постоянной R к числу Авогадро NA: k = R/NA = 1,3807·10 23 Дж/К. Названа по имени Л. Больцмана. * * * БОЛЬЦМАНА ПОСТОЯННАЯ БОЛЬЦМАНА ПОСТОЯННАЯ, физическая постоянная k, равная… … Энциклопедический словарь
Физ. постоянная k, равная отношению универс. газовой постоянной R к числу Авогадро NA: k = R/NА = 1,3807 х 10 23 Дж/К. Названа по имени Л. Больцмана … Естествознание. Энциклопедический словарь
Одна из основных физических постоянных (См. Физические постоянные), равная отношению универсальной газовой постоянной R к числу Авогадро NA. (числу молекул в 1 моль или 1 кмоль вещества): k = R/NA. Названа по имени Л. Больцмана. Б. п.… … Большая советская энциклопедия
