Заболевания скелетных мышц. Воспаление мышц: симптомы и лечение.
Воспаление - это очень болезненное заболевание, которое характеризуется воспалительными процессами в скелетной мускулатуре, с различными причинами возникновения. В медицинской практике имеет название миозит. Основной характеристикой является общая слабость мышц, которая провоцируется воспалительными процессами в мышечных тканях, отвечающих за двигательную нагрузку. К такому воспалению относят и другие виды, связанные с инфекциями, токсинами, а зачастую и с вредным воздействием лекарственных препаратов. Основными воспалительными процессами являются множественные и связанные с поражением поверхностного характера.
Кто чаще болеет миозитом?
По многолетним наблюдениям считается, что частота возникновения такого заболевания от двух до десяти случаев на один миллион среднестатистической популяции человека. Заболевание характеризуется двумя возрастными пиками возникновения. Первый возникает в возрасте от пяти до шестнадцати лет. Второй пик приходится на более старшую группу от сорока до шестидесяти лет. Так же выявлен половой приоритете в заболевании, такой болезнью больше болеют женщины, соотношение заболевших женщин с заболевшими мужчинами колеблется, в среднем, от двух до трёх у женщин к одному у мужчин.
Каковы причины возникновения воспаления?
До сих пор точно не выяснены достоверные причины возникновения данного заболевания. Но именно сезонное влияние, по частоте возникновения, не напрямую указывает на увеличение количества заболеваний в зимний период или в начале весны, а это именно период расцвета превышений эпидемических порогов инфекционных заболеваний. Если рассматривать генетическое влияние на возникновение данных воспалений, то они, в основном, проявляются у однояйцевых близнецов и родственников по прямой линии уже болевших таким заболеванием. Такие ношение генной информации обычно не связано с самой болезнью, а связано с конкретными нарушениями в иммунной системе.
Первые признаки миозита
Основным показателями течения заболевания являются нарушения в иммунных реакциях на клеточном уровне. При иммунально-патологическом исследовании воспаленной области мышц находят патологическую инфильтрацию некоторых клеточных тел, которые находятся в начальном активном состоянии, и выделяют токсин влияющие на восстановительные процессы. При кожном проявлении болезни можно выявить определенные возбудителей заболевания, нарушающих общую клеточную сопротивляемость. Так же выявляется реакция антител, в некоторых случаях имеющая негативные реакции на сосуды.
В первоначальном течении болезни наблюдаются частые обращения заболевших по поводу недомогания и большой слабости и на воспалительные процессы на кожных покровах. С течение времени, нескольких недель, наблюдается рост первоначальных признаков и прирост слабости и , двигательных мышцах рук и ног. В случая заболевания молодого организма наблюдается острое первоначальные признаки, сопровождающиеся ярко выраженными изменениями в конституции тела, то ли похудение, то ли лихорадочными явлениями.
Если рассматривать пожилых больных то они наблюдается постепенное нарастание слабости в мышцах, иногда в течение нескольких лет. Реже проявляются поражения поверхностного кожного покрова. У некоторых больных могут проявляеться и специфические признаки, которые сопровождаются спазмами сосудов и нарушением кровообращения, нарушения в костных тканях и затруднённым дыханием, которое возникает вследствие определённых воспалительных процессах в легких.
Как проявляется болезнь?
Первейшим проявлением данного заболевания является с клинической точки зрения - это всеобщая слабина всех групп мышц отвечающих за двигательную активность и верхней и нижней групп данных мышц, а также шейного отдела. Данные нарушения приводят к тому, что больной очень тяжело двигается в первоначальной фазе после длительного покоя, тяжело подниматься с сидячего положения или заходить или выходить из транспорта или в других повседневных движениях. Со стороны видны нарушения при походке, она становится не четкой, не много не с координированной.
Бывают случаи, когда больной не может самостоятельно подняться с постели. Мышечное воспаление может затронуть и область, связанную с глотанием и голосом, это может сопровождаться острыми затруднениями при попытках глотания, заканчивающиеся взрывным кашлем. Так же у некоторых больных проявляется дерматомиозит, который имеет проявления в виде областей с повышенной сыпью на определенных участках тела или на лице или шее и на других частях тела. Так же присутствуют другие кожные проявления, которые напрямую указывают на течение болезни, они могут сочетаться и с полимиозитными проявлениями, это может быть шелушащиеся и покрасневшие участки кожного покрова или даже сопровождаться микротрещинами кожи на некоторых участках верхних конечностей.
Отложение солей кальция в мягких тканях
Отложение солей в мягких тканях (кальциноз) обычно является продуктом многолетней болезни, на поздних этапах воспалительных процессов. Образования появляются и локализуются обычно под кожей или в местах тканей соединяющих мышцы, над суставными частями колен и локтей, над фалангами пальцев и многих других и даже на некоторых участках ягодиц.
Воспалительные процессы в легких при миозите
Явным первоначальным признаком воспалительных процессов в области легких при миозите является респираторная одышка, он обычно связана с нарушение в работе мышц диафрагмового отдела или неправильной работой сердца или с воспалениями связанными с токсинами содержащихся в принимаемых пациентом препаратах. Так же воспалительные процессы сопровождаться кашлем или недостаточной дыхательной активностью. В особо сложных случаях может развиваться удушливая пневмония.
Как миозит влияет на сердце?
Воспалительные процессы, протекающие в сердечной мышце при миозитах стандартно протекает без ярко выраженных симптоматик. Только при специальном исследовании при помощи кардиограммы наблюдаются некоторые сбои в ритмах биения, которые обычно приписывают к областям других болезней. Сердечных недостаточностей практически не наблюдают.
Диагностика воспалений при лабораторных исследованиях
При проведении исследований крови серьёзных изменений не наблюдают. При других анализах выявляется отклонения которые характерны при нарушениях мышц отвечающих за двигательную активность(КФК). При некоторых течениях болезни они наблюдаются практически у всех больных. Насыщенность этого показателя может расти до тех пор пока не проявятся явные первоначальные признаки выявляемые при клиническом обследовании. Но иногда и этот показатель может быть в пределах нормы и не указывать даже на тяжелые воспаления мышечных тканей. Существует так же при низкой двигательной способности показатель, указывающий на некоторые возможны общие симптомы с гепатитом (трансминазы).
Лечение воспаления мышц
На практике выявляют. Что воспаление мышц это заболевание, которое протекает по периодичной схеме, то есть с обострениями. Боли возникающие при других хронических заболеваниях постоянны, а в случае с этой болезнью периодичны постоянно не беспокоят. Именно миозит имеет два этапа течения болезни хроническую и острую. При правильном прохождении лечения острый этап болезни плавно переходит в хронический, не такой болезненный. При течении хронического этапа болезни воспалительные процессы становятся чувствительны к переменам сезона или к климатическим изменениям. Хроническое воспаление может быть вызвано не только как этапом после острой фазы миозита. Но и при некоторых заболеваниях инфекционного характера. Потому, зачастую, люди даже и не подозревают о миозите, когда болеет обычным инфекционным гриппом, но после выздоровления проявляются признаки поражения мышц. Острое воспаление мышц может проявиться в местной локации.
Обнаружить заболевание миозит очень сложно, потому что оно строго периодично. Но при первых же симптомах необходимо обращаться к специалистам. Это нужно делать по нескольким причинам, но первой должна быть определение точной диагностики, а уже после этого назначение оптимального лечения, главное, что бы оно носило системный характер.
Лечение воспаления мышц может нести в себе правильное распределение рабочих нагрузок на организм при физическом воздействии на болезнь. В некоторых случаях применяют спортивные нагрузки, чередующиеся с периодами полной релаксации. Первоочередной задачей с лечении миозита является выяснение причин воспаления. На основании исследований назначают медикаментозное лечение с помощью специализированных препаратов. Обычно прописывают комплекс средств для излечения, но в каждую систему включают обезболивающие средства на основе анальгетиков и препараты, предотвращающие воспалительные процессы. Применяют множество препаратов но основными являются Диклофенак, Кетонал, Нурофен.
При местных или локальных очагах заболевания применяют особые препараты, назначающиеся в виде мазей согревающего типа: Апизатрон, Никофлекс,Финалгон. При лечении воспалительных процессов у детей обычно назначают специализированные препараты с уменьшенной дозировкой лечащих составляющих, в данном случае есть хорошие отзывы о препарате Доктор МОМ.
В те периоды, когда происходит обострение течения болезни, ни в коем случае нельзя нагружать организм физическими нагрузками и вообще нужно соблюдать постельный режим. Это имеет первоочерёдное значение при воспалительных процессах в области спинного отдела двигательных мышц. При таком обострении требуется прием следующих препаратов болеутоляющего действия и препаратов, предотвращающих воспалительные процессы в список таких средств включены: Бруфен, Реопирин, Индометацин.
Эффективным такое лечение может быть только в том случае. Если оно является системным и применяется комплексно с другими эффективными методами и средствами. Из этого следует, что помимо приема лечащих препаратов, обязательно должны проводиться физиотерапевтические процедуры и очень желательно, что бы применялись упражнения входящие в лечебно-профилактическую физкультуру. Но при этом следует помнить, что при острых миозитах спинного отдела двигательных мышц такая физкультура строго противопоказана. При повышении общей температуре тела во время течения болезни необходимо применять препараты ее, понижающие и обязательно ограничить контакт с холодной атмосферой.
В случаях если воспалительные процессы верхнего отдела мышц, отвечающие за двигательную нагрузку на шею, вызваны септическими поражениями, то после определительной процедуры необходимо обратится к практикующему хирургу, который обязан провести, операбельным путём, вскрытие этой зоны и удалить всю инфекцию. Так же при этом виде воспаления мышц строго запрещен любой вид массажа.
Каждый вид миозита имеет свои, характерные только ему, особенности. Например, воспалительный процесс шейного отдела группы мышц подвергается лечению без особых осложнений и сравнительно легко, если это лечение было начато не на запущенном заболевании, а сразу же при появлении первых же признаков. При лечении этого вида миозита, специалистами, обычно, прописывается малоподвижное лечение или лучше всего постельный режим. Лечащие специалисты прописывают комплекс препаратов и в том числе согревающие мази, которые втирают в область воспаления и принимают препараты, предотвращающие воспалительные процессы.
На практике прекрасный результат дает, так называемая, «новокаиновая блокада». Процесс данного мероприятия заключается в точечном внесении обезболивающего средства вокруг воспаленного участка Новокаином и специальным гормоном. Но это дает положительный эффект, только в тех случаях, если у пациента нет никаких аллергических реакций и противопоказаний. Так же существует метод растяжения мышечных и связочных тканей для релаксационной процедуры. Это абсолютно новый метод, дающий прекрасные результаты и уже опробованный во многих медицинских институтах.
В приложенном видео Вы можете открыть для себя почему восполяются сухожилия.
Но простейшими рекомендациями, которыми сопровождают каждого потенциального пациента хороший специалист, являются рекомендации беречь от холода критические участки мышц, не застаиваться и не пребывать долго в одной статичной позе, как при лежании, так и при сидении. Подбирать только удобные позы, при которых не затекают мышцы, исключать сквозняки и проводит обще укрепляющие упражнения. Эти простые и довольно не сложные рекомендации помогут не подвергать свой понапрасну от воспалительных процессов и миозита.
Воспаление мышц - заболевания, основными симптомами которых выступает мышечная слабость, связанная с воспалением поперечнополосатой мускулатуры. К воспалениям мышц относят идиопатические воспалительные миопатии, миопатии, связанные с инфекцией, и миопатии, связанные с воздействием ЛС и токсинов. Среди них наиболее важными являются признаки полимиозита и дерматомиозита. В этой статье мы рассмотрим симптомы воспаления мышц и основные признаки воспаления мышц у человека. Кроме того, мы расскажем про диагностику воспаленных мышц.
Симптомы воспаления мышц
В дебюте симптомов воспаления мышц большинство больных отмечают признаки недомогания, общей слабости, поражения кожи (при дерматомиозите). В последующем постепенно (в течение нескольких недель) к воспалению мышц присоединяется симптомы прогрессирующего нарастания слабости в проксимальных группах мышц. У некоторых пациентов с признаками воспаления мышц (детей и лиц молодого возраста) наблюдают острое начало, часто сочетающееся с выраженными конституциональными признаками (лихорадка, похудание и др.) и миалгиями.
Очень медленное (в течение нескольких лет) нарастание мышечной слабости при симптомах воспаления мышц наблюдают чаще у пожилых больных, страдающих миозитом с "включениями". Крайне редко развивается так называемый амиотрофический дерматомиозит при воспаленных мышцах, при котором основным признаком очень долго выступает типичное поражение кожи. У больных с антисинтетазным синдромом ранними признаками воспаления мышц могут быть феномен Рейно, полиартралгии или полиартрит и одышка, обусловленная интерстициальным лёгочным фиброзом.
Симптомы поражения мышц при воспалении
Ведущий клинический признак воспаления мышц - симметричная слабость проксимальных групп мышц верхних и нижних конечностей, а также мышц, участвующих в сгибании шеи. Это приводит к затруднению при подъёме с низкого стула, посадке в транспорт, при умывании и причёсывании. Походка при симптомах воспаления мышц становится неуклюжей, ковыляющей, больные не могут подняться без посторонней помощи и оторвать голову от подушки. Воспаление мышц глотки, гортани и пищевода приводит к дисфонии, затруднению глотания, приступам кашля. Признаки поражения дистальной мускулатуры возникают редко (10%), выражено в меньшей степени, чем поражение проксимальной мускулатуры, и выявляется главным образом при миозите с "включениями". У половины больных с симптомами воспаления мышц возможны миалгии или болезненность мышц при пальпации, отёк мышц, но мышечные атрофии развиваются только у больных, длительно страдающих полимиозитом/дерматомиозитом, особенно в отсутствие адекватной терапии. Мышечная гипертрофия характерный признак для мышечных дистрофий и не наблюдается при полимиозите/дерматомиозите.
Симптомы поражения кожи при воспалении мышц
Патогномоничный признак дерматомиозита при воспалении мышц. Кожные признаки включают эритематозную (гелиотропную) сыпь, локализующуюся на верхних веках, скулах, крыльях носа, в области носогубной складки, в зоне "декольте" и на верхней части спины, над локтевыми и коленными, пястно-фаланговыми и проксимальными межфаланговыми суставами, на волосистой части головы. Слегка приподнимающиеся или плоские эритематозные шелушащиеся высыпания, локализующиеся над суставами пальцев кистей, получили название "признак Готтрона" при воспалении мышц. Характерные кожные признаки, наблюдаемые не только при дерматомиозите, но и при полимиозите: покраснение, шелушение и растрескивание кожи ладоней ("рука механика или ремесленника"), гипертрофия кутикулы, околоногтевая эритема, телеангиэктазии. При капилляроскопии сосудов при воспалении мышц околоногтевого ложа отмечают расширение и дилатацию капиллярных петель, чаще при перекрёстном синдроме, реже при дерматомиозите. Фотодерматит и кожный зуд отмечают реже.
Симптомы поражения суставов при воспалении мышц
Симптомы поражения суставов нередко предшествует развитию мышечной патологии при воспалении мышц. Чаще всего вовлекаются мелкие суставы кистей, лучезапястные суставы, реже - локтевые и коленные суставы. Поражение двустороннее симметричное, напоминает таковое при ревматоидном артрите, как правило, имеет преходящий характер, симптомы воспаления мышц быстро купируются при назначении глюкокортикоидов. Однако описано развитие хронического деформирующего артрита с подвывихами суставов кистей, но без эрозивных изменений по данным рентгенологического исследования.
Симптомы кальциноза при воспалении мышц
Признаки кальциноза возникают на поздних стадиях, чаще при ювенильном дерматомиозите. Кальцификаты локализуются подкожно или в соединительной ткани вокруг мышечных волокон, часто в зонах микротравматизации над локтевыми и коленными суставами, на сгибательных поверхностях пальцев и ягодицах.
Симптомы поражения легких при воспалении мышц
Ведущим клиническим признаком воспаления мышц выступает экспираторная одышка, которая может быть связана с поражением диафрагмальных мышц, развитием сердечной недостаточности, интеркуррентной лёгочной инфекцией, токсическим поражением лёгких, связанным с приёмом некоторых препаратов, например метотрексата. Описано развитие симптомов острого диффузного альвеолита, выходящего на первый план в клинической картине воспаления мышц и проявляющегося непродуктивным кашлем и быстропрогрессирующей дыхательной недостаточностью. Чаще наблюдают медленное прогрессирование интерстициального лёгочного фиброза, у некоторых больных выявляемого только при специальном обследовании. В наиболее тяжёлых случаях развивается аспирационная пневмония.
Симптомы поражения сердца при воспалении мышц
Признаки поражения сердца при полимиозите/дерматомиозите в большинстве случаев протекает бессимптомно. Иногда при специальном обследовании выявляют симптомы нарушения ритма и проводимости (тахикардию, аритмию). Застойная сердечная недостаточность, связанная с дилатационной кардиомиопатией, развивается редко. Феномен Рейно чаще наблюдают при дерматомиозите, антисинтетазном синдроме и у больных с перекрёстным синдромом полимиозита/дерматомиозита с системными заболеваниями соединительной ткани.
Признаки других сосудистых нарушений при воспалении мышц
Описаны инфаркты околоногтевого ложа, петехии, livedo reticularis (ветвистый рисунок на коже конечностей и туловища). Поражение почек наблюдают редко, хотя возможно развитие протеинурии и даже нефротического синдрома. Выраженная миоглобинурия может приводить кОПН.
Признаки воспаления мышц
Основное значение в патогенезе полимиозита/дерматомиозита имеют клеточные иммунные реакции. При иммунопатологическом исследовании поражённой мышцы обнаруживают инфильтрацию Т- и В-лимфоцитами и макрофагами, находящимися в активированном состоянии. При этом Т-клетки обладают цитотоксической активностью в отношении миофибрилл. Между полимиозитом и дерматомиозитом выявлены признаки определённых иммунопатологических различий. При дерматомиозите в составе мышечного инфильтрата преобладают СЭ4+-Т-лимфоциты, макрофаги и В-лимфоциты, а при полимиозите - цитотоксические СЭ8+-Т-лимфоциты. Предполагают, что при признаках дерматомиозита развивается гуморальный иммунный ответ, приводящий к активации комплемента, поражающий внутримышечные микрососуды, а при полимиозите преобладают клеточные цитотоксические реакции, опосредуемые СЭ8+-Т-лимфоцитами, синтезирующими цитотоксические субстанции (перфорин, гранзим). Патогенетическое значение миозитспецифических аутоантител при воспалении мышц не доказано.
Причины появления симптомов воспаления мышц
Причины возникновения воспаления мышц точно не выяснены. На роль инфекционных факторов косвенно указывает более частое начало заболевания зимой и ранней весной (особенно у больных ювенильным дерматомиозитом), что по времени совпадает с эпидемиями инфекций. Об участии генетической предрасположенности свидетельствует возможность развития полимиозита/дерматомиозита у монозиготных близнецов и кровных родственников больных. Носительство некоторых Аг главного комплекса гистосовместимости (HLA) более тесно связано не с самим воспалением мышц, а с определёнными иммунными нарушениями, в первую очередь с гиперпродукцией миозитспецифических аутоантител.
Распространённость признаков воспаления мышц
Заболеваемость воспалением мышц в популяции колеблется от 2 до 10 случаев на 1 млн населения в год. В зависимости от возраста наблюдают два пика заболеваемости: в 5- 15 лет (ювенильныи дерматомиозит) и 40-60 лет. Преобладающий пол женский (соотношение количества заболевших женщин и мужчин составляет 2-3:1)
Диагностика воспаления мышц
Общий анализ крови при воспалении мышц: характерных признаков нет, увеличение СОЭ наблюдают редко, главным образом при развитии системных проявлений.
Биохимические анализы крови при диагностике воспаленных мышц
Общепринятый показатель повреждения скелетной мускулатуры - КФК, увеличение которой при полимиозите/дерматомиозите отличается более высокой чувствительностью и специфичностью по сравнению с другими лабораторными тестами. Увеличение КФК при воспалении мышц в различные периоды болезни бывает у 95% больных полимиозитом/дерматомиозитом. Концентрация КФК может возрастать до появления клинических признаков воспаления мышц обострения полимиозита/дерматомиозита, а её уровень может снижаться до развития клинического улучшения. Иногда у больных уровень КФК может быть в пределах нормы, несмотря на тяжёлое повреждение мышц по данным морфологического исследования, в этом случае показатель не коррелирует с динамикой клинических и морфологических признаков активности. Необходимо иметь в виду, что нормальный уровень КФК может наблюдаться у больных с тяжёлой мышечной атрофией на поздних стадиях болезни, в дебюте дерматомиозита и при симптомах опухолевого миозита.
Увеличение МВ-фракции КФК наблюдают при признаках полимиозита/дерматомиозита в отсутствие некроза миокарда. Увеличение активности трансаминаз не специфично для поражения скелетной мускулатуры. У некоторых больных с генерализованной слабостью изолированное увеличение трансаминаз заставляет заподозрить гепатит.
Иммунологическая диагностика воспаленных мышц
К миозитспецифическим AT относят AT к аминоацилсинтетазам транспортной РНК (антисинтетазные AT), в первую очередь AT к гистидил тРНК синтетазе (Jo-1). AT Jo-1 выявляют у половины больных полимиозитом/дерматомиозитом, тогда как другие антисинтетазные AT крайне редко (5%). Продукция антисинтетазных AT ассоциируется с развитием так называемого антисинтетазного синдрома, характеризующегося острым началом, интерстициальным поражением лёгких, лихорадкой, симметричным артритом, феноменом Рейно, поражением кожи кистей по типу "руки механика" при воспалении мышц.
Инструментальные методы определения воспаления мышц
Электромиография для диагностики воспаления мышц - чувствительный, но неспецифичный метод диагностики воспалительных миопатий. К типичным симптомам, наблюдающимся более чем у 90% больных при исследовании проксимальных и параспинальных мышц, относят признаки патологической спонтанной активности миофибрил (потенциалы фибрилляции, сложные повторяющиеся разряды и др.) при раздражении и в покое, короткие низкоамплитудные полифазные потенциалы при сокращении. Нормальная электрическая активность при электромиографии в большинстве случаев позволяет исключить диагноз полимиозита/дерматомиозита. Электромиография - полезный метод контроля за эффективностью лечения воспаления мышц, особенно при сомнительных результатах лабораторных и клинических исследований. Однако данные электромиографии плохо коррелируют с клиническими проявлениями мышечной слабости. Важно, что при стероидной миопатии наблюдают такие же (хотя и менее выраженные) изменения, как и при активном миозите.
Биопсия мышц при симптомах воспаления используется для подтверждения диагноза, даже при наличии характерных клинических, лабораторных и инструментальных признаков воспаления мышц. Наиболее информативна биопсия мышцы, вовлечённой в патологический процесс, но без выраженной атрофии.
Рентгенологические исследования для диагностики воспаления мышц Рентгенологические симптомы воспаления суставов не характерны. При рентгенологическом исследовании лёгких часто выявляют признаки базального пневмосклероза и интерстициального лёгочного фиброза. Более чувствительным методом считают рентгеновскую КТ с высоким разрешением (РКТ).
ЭКГ при диагностики признаков воспаления мышц. Для раннего выявления прогностически неблагоприятных нарушений ритма и проводимости целесообразно проведение суточного мониторирования ЭКГ (по Холтеру).
Симптомы миозита мышц
Миозит с "включениями" - признак воспаления мышц
Среди больных с симптомами воспаления мышц частота миозита с "включениями" колеблется от 15 до 28%. К его признакам относят следующие:
- пожилой возраст больных (средний возраст около 60 лет);
- более частое поражение мужчин (соотношение мужчин и женщин 2:1);
- очень медленное развитие слабости и атрофии не только в проксимальных, но и в дистальных группах мышц - характерный признак при воспалении мышц;
- асимметричность поражения;
- нормальное или умеренное повышение активности КФК;
- редкая ассоциация с системными заболеваниями соединительной ткани и злокачественными новообразованиями;
- отсутствие миозитспецифических и других аутоантител - характерный признак при воспалении мышц;
- резистентность к глюкокортикоидам и другим методам фармакотерапии (особенно характерный признак).
Характерная морфологическая особенность - амилоидогенные "очерченные" васкуоли, крупные внутриядерные и внутрицитоплазматические "включения" (при световой микроскопии) и микротубулярные элементы, выявляемые при электронной микроскопии. Определённое диагностическое значение имеет электромиография, при которой обнаруживают смешанные миопатические и невропатические признаки.
Симптомы миозита, ассоциированного с системными заболеваниями соединительной ткани
Проксимальная мышечная слабость - частый клинический признак системных воспалений мышц, а признаки других болезней этой группы обнаруживают примерно у 20% больных полимиозитом/дерматомиозитом. Симптомы миопатии могут превалировать в клинической картине при системной ССД, СКВ, ревматоидном артрите, синдроме Шёгрена, системных васкулитах. В целом, для перекрёстных синдромов характерны высокая частота феномена Рейно и полиартрита, очень высокие титры антинуклеарного фактора (но отсутствие миозитспецифических аутоантител), хороший ответ на глюкокортикоиды. У больных полимиозитом в сочетании с ССД в сыворотках выявляют AT PM/Scl. Повышение активности КФК при перекрёстных миозитных синдромах при воспалениях мышц выражено в такой же степени, как и при идиопатическом полимиозите/дерматомиозите, а гистологические изменения в мышцах сходны с теми, которые наблюдаются при идиопатических формах заболевания.
Признаки миозита мышц
Признаки миозита при злокачественных новообразованиях при воспалений мышц
Симптомы миозита, ассоциированные с опухолями (опухолевый, или паранеопластический, миозит), составляют примерно 20% от всех случаев воспалительных миопатии. На фоне злокачественных новообразований чаще развивается дерматомиозит, чем полимиозит. Соотношение количества заболевших мужчин и количества заболевших женщин составляет 1:1. Опухоли могут развиваться до появления признаков миопатии, одномоментно или после них. Частота злокачественных новообразований при полимиозите/дерматомиозите в 12 раз выше, чем в общей популяции.
С клинической точки зрения развитие у больных васкулита (или кожного некроза) или амиотрофического дерматомиозита увеличивает вероятность опухолевого миозита, а формирование лёгочного фиброза, появление миозитспецифических аутоантител и других системных проявлений снижают её. Локализация и тип опухолей при воспалении мышц, ассоциирующихся с миозитом, совпадают с их распределением по частоте в соответствующей возрастной группе. Тем не менее опухолевый миозит чаще ассоциирован с раком яичника и носоглотки. При подозрении на опухолевый миозит следует провести дополнительное диагностическое обследование, включающее определение простатспецифического Аг (у мужчин), СА-125 (Аг опухоли яичника).
Кроме болезненных нарушений, полученных при травмах (например, разрывов и растяжений), нарушения в мышцах могут быть и при отсутствии внешних факторов воздействия. К болезням мышц можно отнести:
Мышечная судорога;
Ревматические заболевания;
Воспаления;
Генетические заболевания;
Нарушение обмена веществ;
Изменение мышечных клеток.
Рассмотрим все заболевание более подробно.
Мышечная судорога
Судорога может появиться в результате обезвоживания организма (эксикоза). В этот момент мышцы сократились и стали твердыми, затем они медленно расслабляются. Судорога может возникнуть ночью или утром. Человек резко начинает ощущать сильную боль в мышце. Судороги наиболее часто встречаются у пожилых людей. Когда на мышцы идет слишком большая нагрузка или питание их нарушается, то появляются затвердения. Мышечные волокна перевоплощаются в мышечную ткань, в которой прощупываются твердые участки в виде узлов. В таких случаях необходимо пить много жидкости, для того чтобы восстановить водно-солевой баланс в организме. Также на помощь приходит массаж. Если боли в мышцах не прекращаются, то необходимо показаться врачу. Лечат затвердение при помощи массажа, витамина Е и теплых ванн.
Ревматические заболевания
Есть очень большое количество заболеваний, который можно отнести к ревматическим.. При этих заболеваниях источник поражения – сама мышца, либо кровеносные сосуды, которые питают мышцу. Появляются боли в бедрах и плечах. Некоторые заболевания ревматического характера (например, дерматомиозиты) поражают мышцы. В данном случае необходимо лечение гормонами – глюкокортикоидами. Они подавляют воспаление, но вызывают побочные эффекты. Поэтому ревматические заболевание пробуют подавить с помощью противовоспалительных лекарств или физиотерапии.
Нарушение гормонального характера
Болезненная слабость мышц в медицине именуется как эндокринная миопатия, которая появляется вследствие усиления функции щитовидной железы или надпочечников. После лечения боли исчезают.
Воспаление мышц
Воспаление мышц называется миозитом. Симптомы данного заболевания такие же, как и при ревматизме, но отличительной чертой является воспаление самих мышц. Для миозитов присущи боли и яркая мышечная слабость. Лечат воспаления мышц точно так же, как и ревматические заболевания.
Недостаток минеральных веществ
Для нормального функционирования мышцам необходимы определенные вещества. При дефиците калия возникает паралич. Особенно это чувствуют молодые люди и детки утром после тяжелого прошлого дня. Лечат с помощью препаратов, содержащих калий. Кроме того, перед сном не стоит много есть и активно заниматься спортом.
Недостаток ферментов
У детей может редко наблюдаться дефицит фермента. Часто встречаются нарушения функций ферментов, которые принимают участие в расщеплении глюкозы и гликогена, которые являются источником энергии для мышц. В результате врожденного дефицита фермента мышцы получают мало энергии вследствие ослабления их работы. Человек с таким диагнозом должен избегать физической нагрузки.
Болезненная усталость мышц
Усталость мышц, которая сопровождается болью, появляется вследствие ацидоза. Для получения энергии при больших нагрузках происходит расщепление глюкозы до молочной кислоты, которая тяжело выводится из организма. Накапливаясь в мышцах, молочная кислота вызывает болезненные ощущения.
Во всем мире спортсмены для предотвращения боли в мышцах, улучшения питания, восстановления и лечения употребляют сок из мангустина.
Необходимо употреблять чистую воду.
Для объяснения причин возникновения миодистрофий предложено несколько гипотез (нейрогенная, сосудистая, мембранная), рассматривающих механизмы возникновения прогрессирующих мышечных дистрофий с позиций первичного, генетически детерминированного дефекта.
Прогрессирующая мышечная дистрофия Дюшенна. Заболевание описано Дюшенном в 1853 г. Частота 3,3 на 100 000 населения, 14 на 100 000 родившихся. Наследуется по рецессивному, сцепленному с Х-хромосомой типу. В подавляющем большинстве случаев болеют мальчики. Дистрофия Дюшенна связана с поражением гена, ответственного за выработку дистрофина. При обследовании матерей – носителей гена в генетических консультациях (биопсия ворсинок хориона на 8-9-й неделе) выявляют заболевание у мальчиков. Случаи заболевания у девочек крайне редки, хотя и возможны при кариотипе X0, мозаицизме X0/ХХ, X0/ХХХ, X0/ХХХ/ХХХ и при структурных аномалиях хромосом.
Патоморфология. Характеризуется перерождением мышечной ткани, замещением ее жировой и соединительной тканью, некрозом отдельных волокон.
Клинические проявления. Признаки заболевания проявляются в первые 1-3 года жизни. Уже на 1-м году обращает на себя внимание отставание детей в моторном развитии. Они, как правило, с задержкой начинают садиться, вставать, ходить. Движения неловкие, при ходьбе дети неустойчивы, часто спотыкаются, падают. В 2-3 года появляются мышечная слабость, патологическая мышечная утомляемость, проявляющаяся при физической нагрузке – длительной ходьбе, подъеме на лестницу, изменение походки по типу «утиной». В этот период обращает на себя внимание своеобразная «стереотипная» динамика движений детей во время вставания из горизонтального положения, из положения на корточках или со стула. Вставание происходит поэтапно, с активным использованием рук – «взбирание лесенкой» или «взбирание по самому себе». Атрофии мышц всегда симметричны. Вначале они локализуются в проксимальных группах мышц нижних конечностей – мышцах тазового пояса, бедер, а через 1-3 года быстро распространяются в восходящем направлении на проксимальные группы мышц верхних конечностей – плечевой пояс, мышцы спины. Вследствие атрофии появляются лордоз, «крыловидные» лопатки, «осиная» талия. Типичным, «классическим» симптомом заболевания является псевдогипертрофия икроножных мышц.
При пальпации мышцы плотны, безболезненны. У многих больных в результате селективного и неравномерного поражения различных групп мышц рано возникают мышечные контрактуры и сухожильные ретракции. Мышечный тонус снижен преимущественно в проксимальных группах мышц. Сухожильные рефлексы изменяются с различной последовательностью. В ранних стадиях болезни исчезают коленные рефлексы, позднее – рефлексы с двуглавой и трехглавой мышц. Пяточные (ахилловы) рефлексы длительное время остаются сохранными.
Снижение амплитуды осцилляции и увеличение полифазности.
Одной из отличительных особенностей миодистрофии Дюшенна является сочетание данной формы с патологией костно-суставной системы и внутренних органов (сердечно-сосудистой и нейроэндокринной систем). Костно-суставные нарушения характеризуются деформациями позвоночника, стоп, грудины. На рентгенограммах обнаруживаются сужение костно-мозгового канала, истончение коркового слоя длинных диафизов трубчатых костей.
Сердечно-сосудистые расстройства клинически проявляются лабильностью пульса, артериального давления, иногда глухостью тонов и расширением границ сердца. На ЭКГ регистрируются изменения миокарда (блокада ножек пучка Гиса и др.). Нейроэндокринные нарушения встречаются у 30-50 % больных. Чаще других наблюдаются синдром Иценко-Кушинга, адипозогенитальная дистрофия Бабинского-Фрелиха. Интеллект у многих больных снижен в различной степени.
Течение. Болезнь имеет быстро прогрессирующее злокачественное течение. К 7-10 годам возникают глубокие двигательные расстройства – выраженное изменение походки, снижение мышечной силы, в значительной степени ограничивающие свободное, самостоятельное передвижение больных. К 14-15 годам наступает обездвиженность.
Диагностика и дифференциальный диагноз. Диагноз ставится на основании данных генеалогического анализа (рецессивный сцепленный с Х-хромосомой тип наследования), клинических обострений болезни (раннее начало в 1-3 года, симметричные атрофии проксимальных групп мышц, развивающиеся в восходящем направлении, псевдогипертрофии икроножных мышц, грубые соматические и нейроэндокринные расстройства, снижение интеллекта, быстрое злокачественное течение болезни), данных биохимических исследований (типично раннее, с 5-го дня жизни ребенка, увеличение активности КФК – в 30-50 раз выше нормы), игольчатой электромиографии и морфологических результатов. позволяющих выявить первично-мышечный (миодистрофический) тип поражения.
Дифференцировать заболевание следует от спинальной амиотрофии Верднига-Гоффманна, рахита, врожденного вывиха бедра.
Прогрессирующая мышечная дистрофия Беккера. Заболевание описано Беккером в 1955 г. Частота точно не установлена. Наследуется по рецессивному сцепленному с Х-хромосомой типу.
Клинические проявления. Первые признаки заболевания проявляются в 10-15-летнем возрасте, иногда раньше. Начальные симптомы – мышечная слабость, патологическая мышечная утомляемость при физической нагрузке, псевдогипертрофии икроножных мышц. Атрофии развиваются симметрично. Вначале они локализуются в проксимальных группах мышц нижних конечностей – тазового пояса и бедер, а в дальнейшем распространяются на проксимальные группы мышц верхних конечностей. В результате атрофии возникают изменения походки по типу «утиной», компенсаторные миопатические приемы при вставании. Мышечный тонус в проксимальных группах мышц умеренно снижен. Сухожильные рефлексы длительное время остаются сохранными, рано снижаются только коленные рефлексы. Сердечно-сосудистые расстройства умеренно выражены. Иногда наблюдаются кардиалгии, блокада ножек пучка Гиса. Эндокринные нарушения проявляются гинекомастией, снижением либидо, импотенцией. Интеллект сохранен.
Течение. Заболевание медленно прогрессирует. Темп распространения атрофии невысок, и больные длительное время сохраняют работоспособность.
Диагностика и дифференциальный диагноз. Диагноз ставится на основании генеалогического анализа (рецессивный сцепленный с Х-хромосомой тип наследования), особенностей клинических проявлений (начало болезни в 10-15 лет, атрофии в проксимальных группах мышц, медленное, в течение 10-20 лет, распространение атрофии в восходящем направлении, массивные псевдогипертрофии икроножных мышц, умеренные соматические расстройства, медленное течение), данных биохимических исследований (повышение в крови активности КФК, ЛДГ), игольчатой электромиографии и морфологических результатов, позволяющих выявить первично-мышечный тип изменений.
Дифференцировать болезнь следует от прогрессирующих мышечных дистрофий Дюшенна, Эрба-Рота, спинальной амиотрофии Кугельберга-Веландера.
Прогрессирующая мышечная дистрофия Дрейфуса. Заболевание описано Дрейфусом в 1961 г. Частота не установлена. Наследуется по рецессивному сцепленному с Х-хромосомой типу.
Клинические проявления. Первые признаки заболевания проявляются в 5-7 лет. Как и при других формах прогрессирующих мышечных дистрофий для начала болезни характерны мышечная слабость, патологическая мышечная утомляемость при физической нагрузке. Атрофии возникают симметрично и вначале локализуются в проксимальных группах мышц нижних конечностей – тазового пояса, бедер. Проксимальные группы мышц верхних конечностей вовлекаются в миодистрофический процесс значительно позднее. Отличительными особенностями данной формы являются ранние контрактуры в локтевых суставах, ретракции ахилловых сухожилий. У многих больных имеются нарушения ритма сердечной деятельности. Интеллект сохранен.
Течение. Заболевание медленно прогрессирует.
Диагностика и дифференциальный диагноз. Диагноз ставится на основании генеалогического анализа (рецессивный сцепленный с Х-хромосомой тип наследования), особенностей клиники (начало болезни в 5-7-летнем возрасте, симметричные атрофии с первоначальной локализацией в проксимальных группах мышц нижних, а в дальнейшем с медленным распространением миодистрофий на проксимальные группы мышц верхних конечностей, ранние контрактуры локтевых суставов, ретракции ахилловых сухожилий, сердечно-сосудистые нарушения в виде аритмий сердечной деятельности, медленное, прогрессирующее течение), данных биохимических исследований (высокая активность КФК), электромиографии и морфологических данных, позволяющих выявить первично-мышечный характер изменений.
Дифференцировать болезнь следует от прогрессирующих мышечных дистрофий Беккера, Дюшенна, Эрба-Рота, спинальной амиотрофии Кугельберга-Веландера.
Прогрессирующая мышечная дистрофия Эрба-Рота. Частота 1,5 на 100 000 населения. Наследуется по аутосомно-рецессивному типу.
Патоморфология. Соответствует первично-мышечному поражению.
Клинические проявления. Первые признаки заболевания проявляются преимущественно в 14-16 лет, крайне редко – в 5-10-летнем возрасте. Начальными симптомами являются мышечная слабость, патологическая мышечная утомляемость при физической нагрузке, изменение походки по типу «утиной». Атрофии в начале болезни локализуются в проксимальных группах мышц нижних конечностей. Иногда миодистрофический процесс одновременно поражает мышцы тазового и плечевого пояса. В значительно более поздних стадиях в процесс вовлекаются мышцы спины и живота. Вследствие атрофии возникают лордоз, «крыловидные» лопатки, «осиная» талия. При вставании больные применяют вспомогательные приемы – вставание «лесенкой». Псевдогипертрофии мышц, контрактуры суставов, сухожильные ретракции, как правило, выражены умеренно. Уже в ранних стадиях болезни типично снижение коленных рефлексов и рефлексов с двуглавой и трехглавой мышц плеча.
Течение. Заболевание быстро прогрессирует. Инвалидизация наступает рано.
Диагностика и дифференциальный диагноз. Диагноз ставится на основании данных генеалогического анализа (аутосомно-рецессивный тип наследования), особенностей клиники (начало болезни преимущественно в 14-16 лет, атрофии проксимальных групп мышц, умеренные псевдогипертрофии, быстрое прогрессирование), результатах игольчатой электромиографии и морфологических данных, позволяющих выявить первично-мышечный характер изменений.
Дифференцировать болезнь следует от прогрессирующей мышечной дистрофии Беккера, спинальной амиотрофии Кугельберга-Веландера.
Плечелопаточно-лицевая форма Ландузи-Дежерина. Заболевание описано Ландузи и Дежерином в 1884 г. Частота 0,9-2 на 100 000 населения. Наследуется по аутосомно-доминантному типу.
Клинические проявления. Первые признаки проявляются преимущественно в возрасте 10-20 лет. Мышечная слабость, атрофии локализуются в области мимической мускулатуры лица, лопаток, плеч. Вследствие атрофии лицо становится гипомимичным. Типичны «полированный» лоб, лагофтальм, «поперечная» улыбка, толстые, иногда вывороченные губы («губы тапира»). Атрофии двуглавой и трехглавой мышц плеча, большой грудной, передней зубчатой, трапециевидной мышц обусловливают возникновение симптомов свободных надплечий, «крыловидных» лопаток, появление широкого межлопаточного промежутка, уплощения грудной клетки, сколиоза. В ряде случаев атрофии распространяются на мышцы ног (лопаточно-плечебедренный, лицелопаточно-плечеперонеальный, лицелопаточно-плечеягодично-бедренный, лицелопаточно-плечеягодично-бедренно-перонеальный и другие варианты). Псевдогипертрофии выражены в икроножных и дельтовидных мышцах. Мышечный тонус в ранних стадиях болезни снижен в проксимальных группах мышц. Сухожильные рефлексы снижены преимущественно с двуглавой и трехглавой мышц плеча.
Течение. Как правило, болезнь медленно прогрессирует. Больные длительное время сохраняют работоспособность.
Диагностика и дифференциальный диагноз. Диагноз ставится на основании генеалогического анализа (аутосомно-доминантный тип наследования), особенностей клиники (преимущественно плечелопаточно-лицевая локализация миодистрофического процесса).
Дифференцировать заболевание следует от других прогрессирующих мышечных дистрофий: Эрба-Рота, Беккера.
24.1.2. Нейрогенные амиотрофии
Спинальная амиотрофия Верднига-Гоффманна. Заболевание описано Дж. Верднигом в 1891 г. и Ж. Гоффманном в 1893 г. Частота 1 на 100 000 населения, 7 на 100 000 новорожденных. Наследуется по аутосомно-рецессивному типу.
Патоморфология. Обнаруживаются недоразвитие клеток передних рогов спинного мозга, демиелинизация передних корешков. Часто имеются аналогичные изменения в двигательных ядрах и корешках V, VI, VII, IX, X, XI и XII черепных нервов. В скелетных мышцах нейрогенные изменения характеризуются «пучковой атрофией», чередованием атрофированных и сохранных пучков мышечных волокон, а также нарушениями, типичными для первичных миопатий (гиалиноз, гипертрофия отдельных мышечных волокон, гиперплазия соединительной ткани).
Клинические проявления. Выделяют три формы заболевания: врожденную, раннюю детскую и позднюю, различающиеся временем проявления первых клинических симптомов и темпом течения амиотрофического процесса.
При врожденной форме с первых дней жизни у детей выражены генерализованная мышечная гипотония и гипотрофия мышц, снижение либо отсутствие сухожильных рефлексов. Рано определяются бульбарные расстройства, проявляющиеся вялым сосанием, слабым криком, фибрилляциями языка, снижением глоточного рефлекса. Заболевание сочетается с костно-суставными деформациями: сколиозом, воронкообразной или «куриной» грудной клеткой, контрактурами суставов. Развитие статических и локомоторных функций резко замедлено. Лишь у ограниченного числа детей с большим опозданием формируется способность держать голову и самостоятельно садиться. Однако приобретенные двигательные навыки быстро регрессируют. У многих детей с врожденной формой болезни снижен интеллект. Часто наблюдаются врожденные пороки развития: врожденная гидроцефалия, крипторхизм, гемангиома, дисплазия тазобедренных суставов, косолапость и др.
Течение. Болезнь имеет быстро прогрессирующее течение. Летальный исход наступает до 9-летнего возраста. Одной из основных причин смерти являются тяжелые соматические расстройства (сердечно-сосудистая и дыхательная недостаточность), обусловленные слабостью мускулатуры грудной клетки и снижением участия ее в физиологии дыхания.
При ранней детской форме первые признаки болезни возникают, как правило, на втором полугодии жизни. Моторное развитие в течение первых месяцев удовлетворительное. Дети своевременно начинают держать голову, сидеть, иногда стоять. Заболевание развивается подостро, нередко после инфекции, пищевой интоксикации. Вялые парезы первоначально локализуются в ногах, затем быстро распространяются на мышцы туловища и руки. Диффузные мышечные атрофии сочетаются с фасцикуляциями, фибрилляциями языка, мелким тремором пальцев, сухожильными контрактурами. Мышечный тонус, сухожильные и надкостничные рефлексы снижаются. В поздних стадиях возникают генерализованная мышечная гипотония, явления бульбарного паралича.
Течение. Злокачественное, хотя и мягче по сравнению с врожденной формой. Летальный исход наступает к 14-15 годам жизни.
При поздней форме первые признаки болезни возникают в 1,5– 2,5 года. К этому возрасту у детей полностью завершено формирование статических и локомоторных функций. Большинство детей самостоятельно ходят и бегают. Заболевание начинается незаметно. Движения становятся неловкими, неуверенными. Дети часто спотыкаются, падают. Изменяется походка: они ходят, сгибая ноги в коленях (походка «заводной куклы»). Вялые парезы первоначально локализуются в проксимальных группах мышц нижних конечностей, в дальнейшем сравнительно медленно переходят на проксимальные группы мышц верхних конечностей, мышцы туловища; атрофии мышц обычно малозаметны вследствие хорошо развитого подкожного жирового слоя. Типичны фасцикуляции, мелкий тремор пальцев, бульбарные симптомы – фибрилляции и атрофия языка, снижение глоточного и небного рефлексов. Сухожильные и надкостничные рефлексы угасают уже в ранних стадиях болезни. Костно-суставные деформации развиваются параллельно основному заболеванию. Наиболее выражена деформация грудной клетки.
Течение. Злокачественное, но мягче, чем у первых двух форм. Нарушение способности самостоятельной ходьбы происходит в 10-12-летнем возрасте. Больные живут до 20-30 лет.
Диагностика и дифференциальный диагноз. Диагноз строится на основании данных генеалогического анализа (аутосомно-рецессивный тип наследования), особенностей клиники (раннее начало, наличие диффузных атрофии с преимущественной локализацией в проксимальных группах мышц, генерализованной мышечной гипотонии, фасцикуляций и фибрилляций языка, отсутствие псевдогипертрофий, прогредиентное и в большинстве случаев злокачественное течение и др.), результатах глобальной (накожной) и игольчатой электромиографии и морфологического исследования скелетных мышц, позволяющего выявить денервационный характер изменений.
Дифференцировать врожденную и раннюю формы следует в первую очередь от заболеваний, входящих в группу синдромов с врожденной мышечной гипотонией (синдром «вялого ребенка»): амиатонии Оппенгейма, врожденной доброкачественной формы мышечной дистрофии, атонической формы детского церебрального паралича, наследственных болезней обмена веществ, хромосомных синдромов и др. Позднюю форму следует дифференцировать от спинальной амиотрофии Кугельберга-Веландера, прогрессирующих мышечных дистрофий Дюшенна, Эрба-Рота и др.
Лечение. При спинальной амиотрофии Верднига-Гофмана назначают ЛФК, массаж, препараты, улучшающие трофику нервной ткани – церебролизин, аминалон (гаммалон), пиридитол (энцефабол).
Спинальная юношеская псевдомиопатическая мышечная атрофия Кугельберга-Веландера.
Патоморфология. Обнаруживаются недоразвитие и дегенерация клеток передних рогов спинного мозга, демиелинизация передних корешков, дегенерация двигательных ядер IX, X, XII черепных нервов. В скелетных мышцах – сочетанные изменения, типичные для нейрогенных амиотрофии (пучковая атрофия мышечных волокон) и первичных миодистрофий (атрофии и гипертрофии мышечных волокон, гиперплазия соединительной ткани).
Клинические проявления. Первые признаки заболевания проявляются в 4-8 лет. Описаны случаи начала болезни и в более позднем возрасте – 15-30 лет. В начале болезни характерными симптомами являются патологическая мышечная утомляемость в ногах при длительной физической нагрузке (ходьба, бег), иногда спонтанные подергивания мышц.
Внешне обращают на себя внимание увеличенные икроножные мышцы. Атрофии первоначально локализуются в проксимальных группах мышц нижних конечностей, тазового пояса, бедер и всегда симметричны. Их появление вызывает ограничение двигательных функций в ногах – затруднение при подъеме на лестницу, вставании с горизонтальной поверхности. Постепенно изменяется походка. В стадии выраженных двигательных расстройств она приобретает характер «утиной». Атрофии в проксимальных группах мышц верхних конечностей обычно развиваются спустя несколько лет после поражения нижних конечностей. Вследствие атрофии лопаточной и плечевой областей уменьшается объем активных движений в руках, лопатки становятся «крыловидными». Мышечный тонус в проксимальных группах мышц снижается. Сухожильные рефлексы угасают вначале на ногах, а затем на руках (рефлексы с двуглавой и трехглавой мышц плеча). Характерными симптомами, отличающими спинальную амиотрофию Кугельберга-Веландера от фенотипически сходной первичной прогрессирующей мышечной дистрофии Эрба-Рота, являются фисцикуляции мышц, фибрилляций языка, мелкий тремор пальцев. Костно-суставные нарушения, сухожильные ретракции выражены умеренно либо отсутствуют.
Диагностика и дифференциальный диагноз. Диагноз ставится на основании данных генеалогического анализа (аутосомно-рецессивный, аутосомно-доминантный, рецессивный сцепленный с Х-хромосомой тип наследования), особенностей клиники (начало болезни преимущественно в возрасте 4-8 лет, симметричные атрофии мышц, распространяющиеся по восходящему типу фасцикуляции мышц, мелкий тремор языка, псевдогипертрофии икроножных мышц, медленое прогредиентное течение), результатов глобальной и игольчатой электромиографии и морфологического исследования скелетных мышц, позволяющего выявить денервационный характер изменений.
Дифференцировать болезнь следует от прогрессирующих мышечных дистрофий Беккера, Эрба-Рота, спинальной амиотрофии Верднига-Гоффманна.
Наследственная дистальная спинальиая амиотрофия. Частота не установлена. Наследуется по аутосомно-рецессивному, реже – по аутосомно-доминантному, рецессивному сцепленному с Х-хромосомой типу.
Патоморфология. Соответствует другим спинальным амиотрофия м.
Клинические проявления. Первые признаки заболевания проявляются преимущественно в первой декаде жизни. Начальными симптомами болезни являются слабость и атрофия дистальной мускулатуры ног. В 25 % случаев наблюдаются слабость и атрофия дистальной мускулатуры рук. Отличительные особенности – грубые деформации стоп, ранняя утрата ахиллова рефлекса при сохранности коленных и глубоких рефлексов с рук, отсутствие чувствительных расстройств.
Течение. Болезнь медленно прогрессирует.
Диагностика и дифференциальный диагноз. Диагноз ставится на основании генеалогического анализа (аутосомно-доми-нантный, аутосомно-рецессивный, рецессивный сцепленный с Х-хромосомой тип наследования), особенностей клинической картины (начало в первой декаде жизни, преимущественная локализация атрофии в дистальных отделах нижних конечностей, грубые деформации стоп, отсутствие чувствительных нарушений, медленное прогрессирование миодистрофического процесса), результатов глобальной и игольчатой электромиографии, позволяющей выявить вовлечение в процесс передних рогов спинного мозга.
Дифференцировать заболевание следует от дистальной миопатии Говерса-Веландера, невральной амиотрофии Шарко-Мари-Тута.
Невральная амиотрофия Шарко-Мари-Тута. Частота 1 на 50 000 населения. Наследуется по аутосомно-доминантному, реже – по аутосомно-рецессивному сцепленному с Х-хромосомой типу.
Патоморфология. Обнаруживается сегментарная демиелинизация в нервах, в мышцах – денервация с явлениями «пучковой» атрофии мышечных волокон.
Клинические проявления. Первые признаки заболевания чаще проявляются в 15-30 лет, реже в дошкольном возрасте. В начале болезни характерными симптомами являются мышечная слабость, патологическая утомляемость в дистальных отделах нижних конечностей. Больные быстро устают при длительном стоянии на одном месте и нередко для уменьшения утомления в мышцах прибегают к ходьбе на месте («симптом топтания»). Реже заболевание начинается с чувствительных расстройств – болей, парестезии, ощущения ползания мурашек. Атрофии первоначально развиваются в мышцах голеней и стоп. Мышечные атрофии, как правило, симметричны. Поражаются перонеальная группа мышц и передняя большеберцовая мышца. Вследствие атрофии ноги резко сужаются в дистальных отделах и приобретают форму «перевернутых бутылок» или «ног аиста». Стопы деформируются, становятся «выеденными», с высоким сводом. Парез стол изменяет походку больных. Они ходят, высоко поднимая ноги: ходьба на пятках невозможна. Атрофии в дистальных отделах рук – мышцах тенара, гипотенара, а также в мелких мышцах кистей присоединяются спустя несколько лет после развития амиотрофических изменений в ногах. Атрофии в кистях симметричны. В тяжелых случаях при выраженных атрофкях кисти приобретают форму «когтистых», «обезьяньих». Мышечный тонус равномерно снижен в дистальных отделах конечностей. Сухожильные рефлексы изменяются неравномерно: ахилловы рефлексы снижаются в ранних стадиях болезни, а коленный рефлекс, рефлексы с трех– и двуглавой мышц плеча длительное время остаются сохранными. Чувствительные расстройства определяются нарушениями поверхностной чувствительности по периферическому типу («тип перчаток и носков»). Часто имеются вегетативно-трофические нарушения – гипергидроз и гиперемия кистей и стоп. Интеллект обычно сохранен.
Течение. Болезнь медленно прогрессирует. Прогноз в большинстве случаев благоприятен.
Диагностика и дифференциальный диагноз. Диагноз строится на основании данных генеалогического анализа (аутосомно-доминантный, аутосомно-рецессивный, рецессивный сцепленный с Х-хромосомой тип наследования), особенностей клиники (атрофии дистальных отделов конечностей, расстройства чувствительности по полиневритическому типу, медленное прогрессирующее течение), результатов глобальной, игольчатой и стимуляционной электромиографии (снижение скоростей проведения по чувствительным и двигательным волокнам периферических нервов) и в ряде случаев биопсии нервов.
Дифференцировать заболевание следует от дистальной миопатии Говерса-Веландера, наследственной дистальной спинальной амиотрофии, миотонической дистрофии, периферических нейропатий, интоксикационных, инфекционных полиневритов и других болезней.
Лечение. Терапия прогрессирующих нервно-мышечных заболеваний направлена на улучшение трофики мышц, а также проводимости импульсов по нервным волокнам.
С целью улучшения трофики мыши назначают аденозинтрифосфорную кислоту, кокарбоксилазу, церебролизин, рибоксин, фосфаден, карнитина хлорид, метнонин, лейцин, глутаминовую кислоту. Анаболические гормоны назначают только в виде коротких курсов. Применяют витамины Е, А, группы В и С. Показаны средства, улучшающие микроциркуляцию: никотиновая кислота, ксантинол никотинат, никошпан, пентоксифиллин, пармидин. Для улучшения проводимости назначают антихолинэстеразные препараты: галантамин, оксазил, пиридостигмина бромид, стефаглабрина сульфат, амиридин.
Наряду с медикаментозной терапией применяют лечебную физкультуру. массаж и физиотерапию. Важна профилактика костно-суставных деформаций и контрактур конечностей.
В комплексном лечении больных используют следующие виды физиотерапии: электрофорез лекарственных средств (прозерин, хлорид кальция), диадинамические токи, миостимуляцию синусоидальными модулированными токами, электростимуляцию нервов, ультразвук, озокерит, грязевые аппликации, радоновые, хвойные, сульфидные и сероводородные ванны, оксигенобаротерапию. Показано ортопедическое лечение при контрактурах конечностей, умеренной деформации позвоночника и асимметричном укорочении конечностей. Показаны полноценные белки, калиевая диета, витамины.
Лечение должно быть индивидуальным, комплексным и продолжительным, состоять из последовательных курсов, включающих сочетание различных видов терапии.
24.1.3. Пароксизмальные миоплегии
Наследственные пароксизмальные миоплегии – группа нервно-мышечных заболеваний, характеризующихся внезапными приступами мышечной слабости и плегиями. Наиболее распространенными из наследственных пароксизмальных миоплегии являются гипо-, гипер– и нормокалиемическая формы. Патогенез неясен. Предполагается генетически детерминированный дефект мембраны сарколеммы, нарушающий проницаемость для ионов натрия и калия,
Гипокалиемическая форма пароксизмальной миоплегии (болезнь Вестфаля). Заболевание описано Вестфалем в 1895 г. Наследуется по аутосомно-доминантному типу.
Клинические проявления. Болезнь проявляется в возрасте 6-15 лет. Пароксизмы характеризуются внезапным в ночные или утренние часы развитием мышечной слабости, обездвиженности, снижением мышечного тонуса, сухожильных рефлексов, вегетативными расстройствами – лабильностью пульса, артериального давления, гипергидрозом. Приступы бывают парциальными, охватывающими небольшую группу мышц, и генерализованными. Во время приступа возникают нарушения сердечно-сосудистой деятельности: систолический шум, изменения ЭКГ. Сознание всегда сохранено. Средняя продолжительность приступа – несколько часов, крайне редко пароксизмы держатся несколько суток. Содержание калия в крови во время приступа менее 2 ммоль/л и ниже. Частота приступов вариабельна. Они провоцируются перееданием пищи, богатой углеводами, охлаждением, физическими нагрузками.
Лечение. Диета, богатая калием (чернослив, курага, картофель, изюм). Для купирования приступа назначают 10 % раствор хлорида калия внутрь (по 1 столовой ложке каждый час) или 0,5 % раствор в изотоническом растворе хлорида натрия внутривенно (2-2,5 г на 500 мл раствора в течение часа). Целесообразно применять также панангин внутривенно капельно.
Гиперкалиемическая форма пароксизмальной миоплегин (болезнь Гамсторп). Заболевание описано И.Гамсторп в 1956 г. Наследуется по аутссомно-доминантному типу.
Клинические проявления. Болезнь проявляется в возрасте 1-5 лет. Симптоматика сходна с пароксизмами при гипокалиемической форме и характеризуется внезапным развитием мышечной слабости, плегиями, снижением мышечного тонуса, сухожильных рефлексов, вегетативными расстройствами. В отличие от гипокалиемического гиперкалиемический паралич развивается обычно днем, сопровождается выраженными парестезиями, сочетается со слабостью мышц лица, артикуляционного аппарата, имеет меньшую продолжительность (30-40 мин). Во время приступа содержание калия в крови повышается до 6-7 ммоль/л. Частота приступов вариабельна: от ежедневных до нескольких раз в месяц. В межприступные периоды неврологическая симптоматика отсутствует. Провоцирующими факторами являются голодание, физические нагрузки, вызывающие утомление.
Лечение. Диета с повышенным содержанием углеводов, поваренной соли, ограниченным количеством калия. Вводят 40 мл 40 % раствора глюкозы внутривенно вместе с инсулином подкожно; 20 мл 10 % раствора хлорида кальция внутривенно.
Нормокалиемический (периодический) паралич. Наследуется по аутосомно-доминантному типу.
Клинические проявления. Болезнь проявляется до 10-летнего возраста. Особенностью ее является сравнительно медленно (в течение нескольких суток) пароксизмально нарастающая умеренная слабость в мышцах туловища, конечностей и в жевательной мускулатуре, а также медленный (1-2 нед) регресс симптоматики. Провоцирующими факторами являются продолжительный сон, длительное пребывание в одной позе, переохлаждение.
Лечение. Диета, богатая поваренной солью. Назначают ацетазоламид (диакарб).
Течение. Все формы пароксизмальных миоплегий медленно прогрессируют. Прогноз при своевременно поставленном диагнозе, проведении экстренных мероприятий и дифференцированной медикаментозной терапии благоприятный.
Диагностика и дифференциальный диагноз. Диагноз строится на основании генеалогического анализа, особенностей клинической картины, с учетом возраста, в котором начинается заболевание, времени возникновения пароксизма (ночью, утром, днем, в неопределенное время), степени выраженности мышечной слабости, частоты и длительности приступа, провоцирующих факторов, данных лабораторного биохимического исследования (содержание биоэлектрической активности мышц).
Дифференцировать заболевание следует от миоплегий, развивающихся в результате первичных эндокринных заболеваний, – тиреотоксикоза, болезни Конна (первичный гиперальдостеронизм), болезни Аддисона и др.
Лечение. Показана диета, богатая поваренной солью. Назначают диакарб.
24.1.4. Миотонии
Миотонии – гетерогенная группа нервно-мышечных заболеваний, объединенная общим характерным комплексом нарушений мышечного тонуса, проявляющимся затруднением расслабления мышц после активного сокращения.
Различают наследственные миотонии (стационарные медленно прогрессирующие и периодические, рецидивирующие формы) и миотонические синдромы.
Врожденная миотония (болезнь Лейдена-Томсена). Заболевание впервые описано Лейденом в 1874 г. Томсен в 1876 г. обратил внимание на наследственную природу болезни на примере своей семьи (дети и многие родственники – 20 членов его семьи в 4 поколениях страдали миотонией).
Частота 0,3-0,7 на 100 000 населения. Наследуется по аутосомно-доминантному типу. Пенетрантность более высокая у лиц мужского пола.
Патогенез. Имеют значение нарушения проницаемости клеточной мембраны, изменение ионного и медиаторного обмена (нарушения функциональной взаимосвязи в звене кальций-тропонин-актомиозин), повышенная чувствительность ткани к ацетилхолину и калию.
Патоморфология. При световой микроскопии обнаруживается гипертрофия отдельных мышечных волокон; гистохимически определяется уменьшение размеров II типа мышечных волокон; при электронной микроскопии выявляются умеренная гипертрофия саркоплазматической сети, изменение формы и увеличение размера митохондрий, расширение телофрагмы миофибриллярных волокон.
Клинические проявления. Впервые симптомы заболевания проявляются преимущественно в возрасте 8-15 лет. Ведущими признаками служат миотонические спазмы – затруднения расслабления мышц после активного напряжения. Миотонические спазмы локализуются в раз-личных группах мышц, чаще в мышцах кисти, ног, жевательных мышцах и круговых мышцах глаза. Сильное сжатие пальцев кисти, длительное статическое напряжение ног, смыкание челюстей, зажмуривание глаз вызывают тонические спазмы. Фаза расслабления мышц задерживается на продолжительное время, и больные не в состоянии быстро разжать кисти, изменить положение ног, открыть рот, глаза. Повторные движения уменьшают миотонические спазмы. Повышение механической возбудимости мышц определяется с помощью специальных приемов: при ударе неврологическим молоточком по возвышению I пальца происходит приведение его к кисти (от нескольких секунд до минуты) – «симптом большого пальца», при ударе перкуссионным молоточком по языку на нем появляется ямка, перетяжка – «симптом языка». Внешний вид больных своеобразен. Вследствие диффузных гипертрофии различных мышц они напоминают профессиональных атлетов. При пальпации мышцы плотные, твердые, однако объективно мышечная сила снижена. Сухожильные рефлексы нормальны, в тяжелых случаях снижены.
Течение. Болезнь медленно прогрессирует. Трудоспособность сохраняется в течение длительного времени.
Диагностика и дифференциальный диагноз. Диагноз строится на основании генеалогического анализа (аутосомно-доминантный тип наследования), особенностей клинической картины (атлетический тип телосложения, диффузные гипертрофии мышц, миотонический синдром), данных глобальной электромиографии (миотоническая реакция).
Дифференцировать заболевание следует от других форм миотоний, иногда – от псевдогипертрофических форм прогрессирующих мышечных дистрофий.
Лечение. Назначают дифенин (по 0,1-0,2 г 3 раза в день в течение 2-3 нед), диакарб (по 0,125 г 2 раза в день в течение 2-3 нед), препараты кальция (внутривенно 10 % раствор хлорида кальция по 10 мл или глюконат кальция внутримышечно). Предполагается, что дифенин оказывает тормозящее влияние на моно– и полисинаптическое проведение в ЦНС, а диакарб изменяет проницаемость мембран. Целесообразны физиотерапия в виде гальванического воротника и трусов с кальцием, лечебная гимнастика.
Дистрофическая миотония Россолимо-Штейнерта-Куршмана. Заболевание впервые описано Г. И. Россолимо в 1901 г., а впоследствии Штейнертом и Куршманом в 1912 г. Частота 2,5-5 на 100 000 населения. Наследуется по аутосомно-доминантному типу.
Патогенез. Неясен. Предполагается первичный дефект мембран.
Патоморфология. Методом световой микроскопии обнаруживают сочетание атрофированных и гипертрофированных мышечных волокон, разрастание соединительной ткани, замещение мышечной ткани жировой и соединительной. При электронной микроскопии определяются изменение размеров митохондрий, деструкции миофибриллярного аппарата, саркоплазматической сети.
Клинические проявления. Первые признаки заболевания проявляются в 10-20-летнем возрасте. Характерно сочетание миотонических, миопатических, нейроэндокринных, сердечно-сосудистых нарушений. Миотонический симптомокомплекс, как и при врожденной миотонии Томсена, проявляется миотоническими спазмами, повышенной механической возбудимостью. Степень выраженности миотонического феномена в поздних стадиях болезни при выраженной дистрофии мышц ослабевает. Миопатический синдром характеризуется патологической мышечной утомляемостью, слабостью, мышечными атрофиями, которые локализуются преимущественно в мышцах лица, шеи, дистальных отделов конечностей. Вследствие атрофии внешний вид больных своеобразен: голова опущена на шею, лицо амимичное, худое, особенно в височных областях, веки полуопущены, ноги и руки сужены в дистальных отделах. Типичны «выеденные» стопы, «обезьяньи» кисти. Походка перонеальная («степпаж»), иногда при атрофиях проксимальных групп мышц с компонентом «утиной». Мышечный тонус снижен, сухожильные рефлексы рано угасают. Нейроэндокринные расстройства многообразны. Наиболее выражены изменения в гонадах. У мужчин часто наблюдаются крипторхизм, снижение либидо, импотенция, у женщин – нарушения менструального цикла. У многих больных отмечаются раннее облысение, истончение и сухость кожи. Сердечно-сосудистые расстройства постоянны. Имеются полная или частичная блокада ножек пучка Гиса, низкий вольтаж на ЭКГ, аритмия.
Заболевание медленно прогрессирует.
Диагностика и дифференциальный диагноз. Диагноз ставится на основании данных генеалогического анализа (аутосомно-доминантный тип наследования), особенностей клиники (сочетание миотонических, миопатических, нейроэндокринных, сердечно-сосудистых нарушений), результатов глобальной электромиографии (миотоническая реакция), биохимического исследования крови (инсулинорезистентность).
Дифференцировать заболевание следует от врожденной миотонии Томсена, других миотонических форм, прогрессирующих мышечных дистрофий – дистальной миопатии, невральной амиотрофии.
Лечение. Как и при врожденной миотонии, положительный эффект дают дифенин, диакарб. Показано применение анаболических стероидов (ретаболил, неробол, метиландростендиол). В диете следует уменьшить содержание калия.
24.2. Пирамидные и экстрапирамидные дегенерации
24.2.1. Семейный спастический паралич Штрюмпеля
Хроническое прогрессирующее наследственно-дегенеративное заболевание нервной системы, характеризующееся двусторонним поражением пирамидных путей в боковых и передних канатиках спинного мозга. А. Штрюмпель в 1866 г. отметил семейный характер болезни. Применяется также название «семейная спастическая параплегия Эрба-Шарко-Штрюмпеля».
Этиология и патогенез. Заболевание является наследственным, чаще передается по аутосомно-доминантному, реже – по аутосомно-рецессивному и сцепленному с полом (с Х-хромосомой) типу. Патогенез дегенерации и первичный биохимический дефект неизвестны.
Патоморфология. Наиболее часто поражаются поясничная и грудная части спинного мозга, реже – ствол головного мозга. Отмечается симметричное глиозное перерождение пирамидных путей в боковых и передних канатиках, пучках Голля. Описаны случаи дегенеративных изменений в клетках коры передней центральной извилины, передних рогов спинного мозга, мозжечковых проводниках.
Клинические проявления. Развитие заболевания постепенное. Наиболее часто первые симптомы появляются во втором десятилетии жизни, хотя отмечаются большие колебания возраста, в котором начинается болезнь. Вначале возникают скованность в ногах и быстрая утомляемость при ходьбе, нарастающие по мере прогрессирования заболевания. Развивается характерная спастическая походка, присоединяются варусная и эквиноварусная деформации стоп, изменения стоп по типу «стопы Фридрейха», сухожильные и мышечные контрактуры, особенно в голеностопных суставах. Постепенно слабость в нижних конечностях нарастает, однако полного паралича нижних конечностей не наблюдается. При клиническом обследовании больных уже в начальных стадиях заболевания обнаруживается повышение сухожильных рефлексов, рано появляются патологические рефлексы сгибательной и разгибательной групп (Бабинского, Оппенгейма, Россолимо, Гордона, Шеффера, Бехтерева-Менделя, Жуковского), клонусы стоп, коленных чашечек. Кожные рефлексы в большинстве случаев сохраняются, функции тазовых органов не нарушены. Расстройства чувствительности отсутствуют. Интеллект сохранен. Значительно позже в патологический процесс вовлекаются верхние конечности. Нередко к нижнему спастическому парапарезу присоединяются симптомы поражения зрительных и глазодвигательных нервов, нистагм, дизартрия, атаксия и интенционное дрожание.
Диагностика и дифференциальный диагноз. Диагноз обычно не вызывает затруднений при наличии семейного характера заболевания и типичной клинической картины.
В атипичных спорадических случаях заболевание следует отграничивать от спинальной формы рассеянного склероза, бокового амиотрофического склероза, опухолей спинного мозга и других патологических процессов различной этиологии, вызывающих компрессию спинного мозга, а также фуникулярного миелоза, нейросифилиса и других форм мозжечково-пирамидных дегенерации. Для спинальной формы рассеянного склероза наряду с нижним спастическим парапарезом характерны ремитирующее течение, непостоянство и временная обратимость отдельных симптомов, нарушение функций тазовых органов, выпадение или асимметрия брюшных рефлексов и асимметрия симптомов поражения в целом, изменение иммунологических показателей крови и цереброспинальной жидкости. Решающее значение имеют данные о наследственном характере заболевания. В отличие от бокового амиотрофического склероза болезнь Штрюмпеля начинается в молодом возрасте, отсутствуют признаки поражения периферического мотонейрона (фасцикулярные подергивания, атрофия мелких мышц кисти, характерные изменения ЭМГ), бульбарных расстройств. При дифференциации от экстрамедуллярных опухолей и синдрома компрессии спинного мозга другой этиологии имеют значение сегментарные расстройства чувствительности, асимметрия поражения конечностей, наличие блока субарахноидального пространства и белково-клеточная диссоциация в цереброспинальной жидкости при люмбальной пункции, характерные для опухолей. При нейросифилисе в отличие от болезни Штрюмпеля в анамнезе имеются указания на кожные проявления. Ведущими в клинической картине являются симптомы поражения задних канатиков спинного мозга, определяются характерные зрачковые расстройства, изменения в крови, цереброспинальной жидкости.
Дифференциальная диагностика семейной спастической параплегии с другими дегенеративными поражениями спинного мозга бывает иногда затруднительной. Помогает выявление симптомов поражения других отделов нервной системы (мозжечковых, глазных и др.).
Течение и прогноз. Течение заболевания медленно прогрессирующее; отмечается более злокачественное течение при возникновении его в раннем возрасте. При позднем развитии болезни гипертония и гиперрефлексия преобладают над двигательными нарушениями. Прогноз для жизни благоприятный. Степень утраты трудоспособности зависит от выраженности нарушения функций нервной системы.
Лечение. Симптоматическое. Назначают препараты, снижающие мышечный тонус, – мидокалм, баклофен, изопротан (скутамил), транквилизаторы: сибазон (седуксен), нозепам (тазепам), хлозепид (элениум). Показаны физиотерапевтические процедуры, парафиновые аппликации на мышцы нижних конечностей. Применяются точечный массаж, рефлексотерапия, лечебная физкультура, при необходимости – ортопедические мероприятия. Показаны курсы общеукрепляющего лечения: витамины группы В, метаболические препараты: пирацетам (ноотропил), пиридитол (энцефабол), аминалон, церебролизин, аминокислоты, АТФ, кокарбоксилаза, препараты, улучшающие микроциркуляцию.
24.2.2. Болезнь Паркинсона
Заболевание впервые описано английским врачом Джеймсом Паркинсоном, который назвал его дрожательным параличом. В 1877 г. Жан Мартен Шарко дополнил клиническую характеристику болезни. Заболевание встречается у 60-140 на 100 000 населения; частота его резко увеличивается с возрастом. Согласно статистическим данным, дрожательный паралич встречается у 1 % населения до 60 лет и у 5 % более старшего возраста. Мужчины болеют несколько чаще, чем женщины.
Этиология и патогенез. Клинические проявления дрожательного паралича и синдрома паркинсонизма возникают в результате перенесенных острых и хронических инфекций нервной системы (эпидемический энцефалит Экономо, клещевой, вирусный и другие виды энцефалитов). Причинами болезни могут служить церебральный атеросклероз, сосудистые заболевания головного мозга, опухоли, травмы нервной системы, длительное использование препаратов фенотиазинового ряда (аминазин, трифтазин), производных раувольфии, метилдофа – лекарственный паркинсонизм. Паркинсонизм может развиваться при острой или хронической интоксикации окисью углерода и марганца. В возникновении акинетико-ригидного синдрома может иметь значение наследственно обусловленное нарушение обмена катехоламинов в мозге или неполноценность ферментных систем, контролирующих этот обмен. Часто выявляется семейный характер заболевания при аутосомно-доминантном типе наследования. Подобные случаи относят к болезни Паркинсона. Различные экзо– и эндогенные факторы (атеросклероз, инфекции, интоксикации, травмы) способствуют проявлению генуинных дефектов в механизмах обмена катехоламинов в подкорковых ядрах и возникновению заболевания.
Основным патогенетическим звеном дрожательного паралича и синдрома паркинсонизма является нарушение обмена катехоламинов (дофамина, норадреналина) в экстрапирамидной системе. Дофамин выполняет самостоятельную медиаторную функцию в реализации двигательных актов. В норме концентрация дофамина в базальных узлах во много раз превышает его содержание в других структурах нервной системы. Ацетилхолин является медиатором возбуждения между полосатым телом, бледным шаром и черным веществом. Дофамин является его антагонистом, действуя тормозяще. При поражении черного вещества и бледного шара снижается уровень дофамина в хвостатом ядре и скорлупе, нарушается соотношение между дофамином и норадреналином, возникает расстройство функций экстрапирамидной системы. В норме импульсация модулируется в сторону подавления хвостатого ядра, скорлупы, черного вещества и стимулирования бледного шара. При выключении функции черного вещества возникает блокада импульсов, поступающих из экстрапирамидных зон коры большого мозга и полосатого тела к передним рогам спинного мозга. В то же время к клеткам передних рогов поступают патологические импульсы из бледного шара и черного вещества. В результате усиливается циркуляция импульсов в системе альфа– и гамма-мотонейронов спинного мозга с преобладанием альфа-активности, что приводит к возникновению паллидарно-нигральной ригидности мышечных волокон и тремора – основных признаков паркинсонизма.
Патоморфология. Основные патологоанатомические изменения при паркинсонизме наблюдаются в черном веществе и бледном шаре в виде дегенеративных изменений и гибели нервных клеток. На месте погибших клеток возникают очаги разрастания глиальных элементов или остаются пустоты.
Клинические проявления. Основной клинический синдром – акинетико-ригидный или гипертонически-гипокинетический. Для дрожательного паралича и паркинсонизма характерны гипо– и акинезия. Появляется своеобразная сгибательная поза: голова и туловище наклонены вперед, руки полусогнуты в локтевых, лучезапястных и фаланговых суставах, нередко плотно приведены к боковым поверхностям грудной клетки, туловища, ноги полусогнуты в коленных суставах. Отмечается бедность мимики. Темп произвольных движений с развитием заболевания постепенно замедляется, иногда довольно рано может наступить полная обездвиженность. Походка характеризуется мелкими шаркаюшими шагами. Нередко наблюдается склонность к непроизвольному бегу вперед (пропульсии). Если толкнуть больного вперед, он бежит, чтобы не упасть, как бы «догоняя свой центр тяжести». Часто толчок в грудь ведет к бегу назад (ретропульсии), в сторону (латеропульсии). Эти движения наблюдаются также при попытке сесть, встать, откинуть голову назад. Часто при резко выраженном синдроме позы больного напоминают каталептические. Акинез и пластическая гипертония особенно резко проявляются в мускулатуре лица, жевательных и затылочных мышцах, мышцах конечностей. При ходьбе отсутствуют содружественные движения рук (ахейрокинез). Речь тихая, монотонная, без модуляций, с наклонностью к затуханию в конце фразы.
При пассивном движении конечностью отмечаются своеобразное мышечное сопротивление вследствие повышения тонуса мышц-антагонистов, феномен «зубчатого колеса» (возникает впечатление, что суставная поверхность состоит из сцепления двух зубчатых колес). Повышение тонуса мыщц-антагонистов при пассивных движениях можно определить следующим приемом: если поднять голову лежащего, а потом резко отпустить руку, то голова не упадет на подушку, а опустится относительно плавно. Иногда голова в положении лежа несколько приподнята – феномен «воображаемой подушки».
Тремор – характерный, хотя и не обязательный для синдрома паркинсонизма симптом. Это ритмичное, регулярное, непроизвольное дрожание конечностей, лицевой мускулатуры, головы, нижней челюсти, языка, более выраженное в покое, уменьшающееся при активных движениях. Частота колебаний 4-8 в секунду. Иногда отмечаются движения пальцами в виде «скатывания пилюль», «счета монет». Тремор усиливается при волнениях, практически исчезает во сне.
Психические нарушения проявляются утратой инициативы, активности, сужением кругозора и интересов, резким понижением различных эмоциональных реакций и аффектов, а также некоторой поверхностью и медлительностью мышления (брадифрения). Наблюдаются брадипсихия – трудное активное переключение с одной мысли на другую, акайрия – прилипчивость, вязкость, эгоцентризм. Иногда возникают пароксизмы психического возбуждения.
Вегетативные нарушения проявляются в виде сальности кожи лица и волосистой части головы, себореи, гиперсаливации, гипергидроза, трофических нарушений в дистальных отделах конечностей. Выявляется нарушение постуральных рефлексов. Иногда специальными методами исследования определяется нерегулярное по частоте и глубине дыхание. Сухожильные рефлексы, как правило, без отклонений. При атеросклеротическом и постэнцефалитическом паркинсонизме могут определяться повышение сухожильных рефлексов и другие признаки пирамидной недостаточности. При постэнцефалитическом паркинсонизме встречаются так называемые окулогирные кризы – фиксация взора кверху в течение нескольких минут или часов; иногда голова при этом запрокинута. Кризы могут сочетаться с нарушением конвергенции и аккомодации (прогрессирующий супрануклеарный паралич).
Принято различать несколько клинических форм дрожательного паралича и паркинсонизма; ригидно-брадикинетическую, дрожательно-ригидную и дрожательную. Ригидно-брадикинетическая форма характеризуется повышением тонуса мышц по пластическому типу, прогрессирующим замедлением активных движений вплоть до обездвиженности; появляются мышечные контрактуры, флексорная поза больных. Эта форма паркинсонизма, наиболее неблагоприятная по течению, чаще наблюдается при атеросклеротическом и реже при постэнцефалитическом паркинсонизме. Дрожательно-ригидная форма характеризуется тремором конечностей, преимущественно их дистальных отделов, к которому с развитием заболевания присоединяется скованность произвольных движений. Для дрожательной формы паркинсонизма характерно наличие постоянного или почти постоянного средне– и крупноамплитудного тремора конечностей, языка, головы, нижней челюсти. Тонус мышц нормальный или несколько повышен. Темп произвольных движений сохранен. Эта форма чаще встречается при постэнцефалитическом и посттравматическом паркинсонизме.
Данные лабораторных и функциональных исследований. При посттравматическом паркинсонизме выявляется повышение давления цереброспинальной жидкости при нормальном клеточном и белковом ее составе. При паркинсонизме, возникающем вследствие отравления окисью углерода, в крови обнаруживается карбоксигемоглобин, при марганцевом паркинсонизме – следы марганца в крови, моче, цереброспинальной жидкости. Глобальная электромиография при дрожательном параличе и паркинсонизме выявляет нарушение электрогенеза мышц – повышение биоэлектрической активности мышц в покое и наличие ритмических групповых разрядов потенциалов. При электроэнцефалографии обнаруживаются преимущественно диффузные негрубые изменения биоэлектрической активности головного мозга.
Диагностика и дифференциальный диагноз. В первую очередь следует дифференцировать болезнь Паркинсона от синдрома паркинсонизма. Для постэнцефалитического паркинсонизма характерны глазодвигательные симптомы; могут наблюдаться кривошея, явления торсионной дистонии, которые никогда не наблюдаются при дрожательном параличе. Встречаются нарушения сна, дыхательные дискинезии с приступами зевоты, кашля, адипозогенитальные нарушения, вегетативные пароксизмы. Посттравматический паркинсонизм достоверно можно диагностировать у больных молодого и среднего возраста. Заболевание развивается после тяжелой, иногда повторной черепно-мозговой травмы. Для посттравматического паркинсонизма нехарактерны антеретропульсии, судорога взора, расстройства жевания, глотания, дыхания, каталептоидные явления. В то же время часто встречаются вестибулярные расстройства, нарушение интеллекта и памяти, зрительные галлюцинации (вследствие поражения коры большого мозга). Нередко отмечаются регредиентное течение или стабилизация патологического процесса. Для диагностики марганцевого паркинсонизма имеют значение анамнез (сведения о работе в контакте с марганцем или его окислами), обнаружение марганца в биологических жидкостях. Диагностика оксиуглеродного паркинсонизма базируется на определении в крови карбоксигемоглобина.
При атеросклеротическом паркинсонизме дрожание и ригидность сочетаются с признаками церебрального атеросклероза или возникают после острых нарушений мозгового кровообращения. Выявляются очаговые неврологические симптомы в виде пирамидной недостаточности, выраженных псевдобульбарных симптомов. Часто определяется унилатеральность ригидности и скованности. В крови обнаруживается дислипидемия, характерная для атеросклероза. Регистрируются определенные изменения РЭГ в виде уплощения пульсовых волн.
Клиническая картина, напоминающая болезнь Паркинсона, может наблюдаться при сенильной атеросклеротической деменции, для которой наиболее характерны грубые психические расстройства вплоть до деменции. Ригидность и скованность выражены умеренно, тремор, как правило, отсутствует. Отдельные клинические проявления паркинсонизма могут обнаруживаться при других наследственно-дегенеративных заболеваниях нервной системы: атаксии Фридрейха, оливопонтоцеребеллярной атрофии, ортостатической гипокинезии, болезни Крейтцфельда-Якоба. При этих заболеваниях наряду с акинетико-ригидными симптомами имеются прогрессирующие явления мозжечковой атаксии.
Течение и прогноз. Заболевание неуклонно прогрессирует. Исключение составляют некоторые формы, обусловленные лекарственными интоксикациями (при отмене препаратов может наступить улучшение состояния). Общепризнано, что лечение в начальной стадии позволяет уменьшить выраженность симптомов, замедлить прогрессирование заболевания. В поздних стадиях лечебные мероприятия менее эффективны. Заболевание приводит к инвалидизации в течение нескольких лет. Даже лечение леводопой в настоящее время замедляет течение на непродолжительное время. Это подтверждает положение, что в основе заболевания лежит не только первичный биохимический дефект, но и еще не изученный нейропатологический процесс.
Лечение. Лечение больных с дрожательным параличом и синдромом паркинсонизма должно быть комплексным, длительным и включать специфические антипаркинсонические препараты, седативные средства, физиотерапевтические процедуры, лечебную физкультуру, психотерапию с учетом этиологического фактора, возраста больных, клинической формы и стадии болезни, а также наличия сопутствующих заболеваний. При легких формах вначале назначают амантадин (мидантан) и парасимпатолитики, так как они вызывают меньше побочных явлений. Применяют центральные парасимпатолитики (циклодол, наркопан), пиридоксин, амантадин, агонисты дофаминовых рецепторов (бромокриптин, лизурид).
При выраженных клинических проявлениях паркинсонизма в настоящее время базисным препаратом является леводопа, обычно в сочетании с ингибитором декарбоксилазы. Дозы увеличивают медленно, в течение нескольких недель, до получения клинического эффекта. Побочные действия препарата – дистонические нарушения и психозы. Леводопа, попадая в ЦНС, декарбоксилируется в допамин, необходимый для нормальной функции базальных ганглиев. Препарат влияет прежде всего на акинезию и в меньшей степени – на другие симптомы. При сочетании леводопы с ингибитором декарбоксилазы можно уменьшить дозу леводопы и тем самым уменьшить риск развития побочных явлений.
В арсенале симптоматических антипаркинсонических средств большое место занимают холинолитические препараты, которые, блокируя м– и н-холинорецепторы, способствуют расслаблению поперечнополосатой и гладкой мускулатуры, уменьшают насильственные движения и явления брадикинезии. Это естественные и синтетические атропиноподобные препараты: беллазон (ромпаркин), норакин, комбипарк. Применяют также препараты фенотиазинового ряда: динезин, депаркол, парсидол, дипразин. Основная причина многообразия медикаментозных препаратов, используемых для лечения паркинсонизма, в недостаточной их лечебной эффективности, наличии побочных явлений, индивидуальной непереносимости и быстром привыкании к ним.
Хирургическое лечение. Несмотря на большие успехи, достигнутые в медикаментозном лечении паркинсонизма, возможности его в ряде случаев ограничены.
Наиболее широко применяемый препарат леводопа в большей степени способствует устранению таких симптомов болезни, как акинезия, общая скованность, в меньшей степени он влияет на ригидность мышц и тремор. Приблизительно у 25 % больных этот препарат практически неэффективен или плохо переносится.
В этих случаях возникают показания для стереотаксической операции на подкорковых узлах. Обычно производится локальное разрушение вентролатерального ядра зрительного бугра, субталамических структур или бледного шара.
С помощью операции удается в большинстве случаев добиться положительного эффекта – снижения мышечного тонуса, ослабления или прекращения тремора, уменьшения гипокинезии.
Операция обычно выполняется на стороне, противоположной той, на которой преобладают симптомы паркинсонизма. При показаниях производится двустороннее разрушение подкорковых структур.
В последние годы для лечения паркинсонизма используется также имплантация эмбриональной ткани надпочечника в полосатое тело. О клинической эффективности таких операций пока говорить преждевременно.
Стереотаксические операции на подкорковых структурах применяются также и при других заболеваниях, сопровождающихся насильственными движениями (гемибаллизм, хореоатетоз, кривошея и некоторые другие).
Трудоспособность при болезни Паркинсона и паркинсонизме зависит от степени выраженности двигательных нарушений, вида профессиональной деятельности. При легких и умеренных нарушениях двигательных функций больные длительно сохраняют трудоспособность при различных видах умственного труда, а также работах, не связанных с физическим напряжением и выполнением точных и координированных движений. При выраженных проявлениях заболевания больные нетрудоспособны и нуждаются в посторонней помощи.
24.2.3. Гепатоцеребральная дистрофия
Гепатоцеребральная дистрофия (гепатолентикулярная дегенерация, болезнь Вестфаля-Вильсона-Коновалова) – хроническое прогрессирующее наследственно-дегенеративное заболевание, характеризующееся сочетанным поражением подкорковых узлов ЦНС и печени. Описано в 1883 г. К. Вестфалем и в 1912 г. С. Вильсоном. Термин «Гепатоцеребральная дистрофия» предложен Н.В. Коноваловым.
Этиология и патогенез. Заболевание наследственное. Тип наследования аутосомно-рецессивный. Ведущим патогенетическим звеном является генетически обусловленное нарушение синтеза белка церулоплазмина, входящего в состав а2-глобулина, транспортирующего медь. Вследствие этого создается высокая концентрация меди в крови и происходит ее отложение в органах и тканях, преимущественно в печени, мозге, роговице, а также в почках и других органах. Токсическое действие меди связано с блоком сульфгидрильных групп в окислительных ферментах, что приводит к нарушению окислительно-восстановительных процессов в клетке.
Патоморфология. В мозге, печени, почках, селезенке, роговице, радужной оболочке, хрусталике глаза определяются дегенеративные изменения, наиболее выраженные в подкорковых ядрах. Обнаруживаются также дистрофические изменения нервных клеток, очаговые размягчения мозговой ткани с образованием микрокист, разрастанием глии. Выявляются изменения мелких сосудов мозговой ткани, кровоизлияния вокруг них, периваскулярный отек. Постоянным признаком заболевания является цирроз печени.
Клинические проявления. Складываются из симптомов поражения ЦНС и внутренних органов. У больных появляются и нарастают мышечная ригидность, разнообразные гиперкинезы, псевдобульбарные симптомы, прогрессирующее снижение интеллекта, нарушения функции печени и изменение радужной оболочки. Ведущим является синдром экстрапирамидных расстройств: ригидность мышц туловища, конечностей, лица, глотки и как следствие этого – нарушения походки, глотания, речи. Параллельно возникают гиперкинезы различного характера: тремор, атетоз, торсионная дистония, интенционное дрожание, усиливающиеся при попытке выполнения произвольных движений. Гиперкинезы имеют неритмичный характер.
В зависимости от выраженности и сочетания клинических проявлений, возраста, в котором возникло заболевание, и степени поражения печени выделяют четыре формы гепатоцеребральной дистрофии.
1. Ранняя ригидно-аритмогиперкинетическая форма имеет наиболее злокачественное течение. Неврологические проявления развиваются в возрасте 7-15 лет. Этому, как правило, предшествуют признаки поражения печени. В клинической картине преобладают мышечная ригидность и гиперкинезы.
2. Дрожательно-ригидная и дрожательная формы, проявляющиеся в более позднем возрасте (17-20 лет). Характеризуются одновременным появлением ригидности и дрожания, которое часто бывает первым признаком заболевания; постепенно нарастая, оно может становиться общим, захватывая мышцы туловища, конечностей, лица, челюстей, мягкого неба, надгортанника, голосовых связок, дыхательную мускулатуру, диафрагму. Нарушается глотание, речь становится скандированной. Часто отмечаются выраженные изменения психики.
3. Экстрапирамидно-корковая форма, выделенная Н.В. Коноваловым, отличается расстройством высших мозговых функций, наличием параличей, часто эпилептических припадков, грубым снижением интеллекта с изменениями личности.
4. Абдоминальная форма характеризуется преимущественным нарушением функции печени. Неврологические симптомы присоединяются в более поздних стадиях болезни.
Течение и прогноз. Течение неуклонно прогрессирующее. Продолжительность жизни зависит от клинической формы заболевания, своевременности начатого лечения. Средняя продолжительность жизни больных без лечения около 6 лет.
Данные лабораторных и функциональных исследований. В сыворотке крови обнаруживаются значительное снижение содержания церулоплазмина (ниже 10 ЕД при норме 25-45 ЕД), гипопротеинемия, гиперкупрурия (до 1000 мкг/сут и выше при норме 150 мкг/сут) и гипераминоацидурия (до 1000 мг/сут при норме 350 мг/сут). Возможны также повышение содержания аммиака в крови, изменение печеночных проб. Патогномоничным признаком гепатоцеребральной дистрофии является роговичное кольцо Кайзера-Флейшера, которое представляет собой отложение пигмента, содержащего медь, по периферии радужной оболочки.
Дифференциальный диагноз. Заболевание следует дифференцировать от летаргического энцефалита, малой хореи, дегенеративных подкорковых заболеваний, рассеянного склероза. Выявление семейного анамнеза, характерной клинической картины, роговичного кольца Кайзера-Флейшера, низкого уровня церулоплазмина в крови и повышения экскреции меди с мочой у больных и их родственников позволяет поставить диагноз гепатоцеребральной дистрофии.
Лечение. Основной целью лечения является выведение из организма избытка меди. Для этого используют тиоловые препараты, к которым относятся унитиол, декаптол и D-пеницилламин. Дозы подбираются индивидуально. 0-пеницилламин в среднем назначают в дозе от 0,45 до 2 г в сутки после еды. Препарат необходимо принимать в течение всей жизни.
Наиболее эффективно лечение в ранних стадиях болезни. Унитиол назначают повторными курсами по 5 мл 5 % раствора внутримышечно ежедневно или через день (на курс 25 инъекций с перерывом между курсами 5-6 мес). Лечение сочетают с препаратами, улучшающими функции печени. Рекомендуется специальная диета с ограничением продуктов, богатых медью (печень, грибы, шоколад, устрицы и др.), животных жиров, белков. Пища должна быть богата витаминами и углеводами.
24.2.4. Торсионная дистопия
Хроническое прогрессирующее заболевание нервной системы, клинически проявляющееся изменениями мышечного тонуса и непроизвольными тоническими сокращениями мышц туловища и конечностей.
Этиология и патогенез. Различают идиопатическую (семейную) торсионную и симптоматическую дистонию. Тип наследования при идиопатической торсионной дистонии как аутосомно-доминантный, так и аутосомно-рецессивный. Симптоматическая торсионная дистония встречается при гепатоцеребральной дистрофии, хорее Гентингтона, опухолях мозга, эпидемическом энцефалите, детском церебральном параличе. Имеются указания, что в патогенезе наследственной торсионной дистонии имеет значение нарушение допаминового обмена. При обследовании у этих больных обнаруживается повышение содержания допамин-?-гидроксилазы в сыворотке крови.
Патоморфология. Дистрофические изменения обнаруживаются преимущественно в мелких нейронах в области скорлупы чечевицеобразного ядра, реже – в других базальных ганглиях.
Клинические проявления. Развивается заболевание постепенно, в 2/3 случаев в возрасте до 15 лет. В детском возрасте первыми симптомами болезни могут быть нарушение походки, спастическая кривошея; у взрослых чаще встречаются первично-генерализованные формы. В результате нарушения соотношения функции мышц-синергистов и антагонистов возникают насильственные длительные тонические сокращения мышц туловища, головы, тазового пояса, конечностей, обычно ротаторного характера, сочетающиеся с атетоидными движениями в пальцах. Создается впечатление, что мышцы постоянно сокращаются для преодоления действия антагонистов. Возникающие позы, даже самые неудобные, сохраняются в течение длительного времени. Гиперкинезы усиливаются при волнении, активных движениях, во сне исчезают. Постепенно, по мере прогрессирования заболевания, поза пациента становится постоянно дистонической, с усиленным поясничным лордозом, флексией бедер, медиальной ротацией рук и ног. В зависимости от распространенности дистонических явлений выделяют локальную и генерализованную формы заболевания. При локальных дистонических симптомах возникает тоническое сокращение отдельных мышечных групп, нарушаются произвольные движения и возникает аномальная поза. К таким симптомам относятся спастическая кривошея, писчий спазм, оромандибулярная дистония (открывание и закрывание рта и непроизвольные движения языка), блефароспазм, щечно-лицевая, щечно-язычная дистония, хореоатетоз.
Течение и прогноз. Заболевание в большинстве случаев неуклонно прогрессирует. Иногда отмечаются различной длительности ремиссии. Быстро происходит глубокая инвалидизация больных и наступает летальный исход, особенно при генерализованной форме.
Лечение. Длительное, симптоматическое. Применяют комбинации холинолитиков и седативных препаратов, в некоторых случаях эффективно использование леводопы. Назначается также галоперидол или резерпин. Очень редко прибегают к стереотаксическим операциям на подкорковых ядрах.
24.2.5. Хорея Гентингтона
Хроническое прогрессирующее наследственно-дегенеративное заболевание, характеризующееся нарастающим хореическим гиперкинезом и деменцией. Описано Дж.Гентингтоном в 1872 г. Частота хореи Гентингтона от 2 до 7 случаев на 100 000 населения. Применяется также термин «деменция хореическая».
Этиология и патогенез. Заболевание наследственное. Тип наследования аутосомно-доминантный с высокой пенетрантностью (80-85 %). Мужчины болеют чаще. Патогенез изучен недостаточно. В клетках головного мозга в ряде случаев обнаружен недостаток ГАМК, в клетках черного вещества – повышение содержания железа, имеются нарушения допаминового обмена. Изучен патофизиологический механизм двигательных расстройств. Блок стрионигральных связей обусловливает отсутствие контроля над содружественностью движений и мышечного тонуса со стороны черного вещества, которое передает полученные от премоторной зоны коры импульсы к клеткам передних рогов спинного мозга в нерегулярной последовательности.
Патоморфология. Обнаруживается атрофия мозга. В подкорковых ганглиях, преимущественно в скорлупе и хвостатом ядре, определяются грубые дегенеративные изменения мелких и крупных клеток, уменьшение их числа, разрастание глиальных элементов.
Клинические проявления. Возникает заболевание обычно в возрасте 30 лет и старше. Первыми симптомами могут быть интеллектуальные расстройства, в дальнейшем посгепенно развивается деменция. Одновременно появляются хореические гиперкинезы: быстрые, неритмичные, беспорядочные движения в различных мышечных группах. Выполнение произвольных движений затруднено вследствие гиперкинезов и сопровождается рядом ненужных движений. Так, например, при ходьбе больные гримасничают, жестикулируют, приседают, широко расставляют руки. Однако даже при выраженном гиперкинезе, особенно в начале болезни, они могут его сознательно подавлять. Речь затруднена и также сопровождается излишними движениями. Мышечный тонус снижен. Парезы конечностей и другие очаговые неврологические симптомы не определяются. Нередко наблюдаются эндокринные и нейротрофические расстройства. В 5-16 % случаев диагностируется атипичный акинетико-ригидный вариант хореи Гентингтона. При этом развивается акинетико-ригидный синдром в сочетании с прогрессирующей интеллектуальной деградацией и умеренно выраженным хореическим гиперкинезом. Из насильственных движений преобладает хореоатетоз.
Течение. Заболевание неуклонно прогрессирует. Длительность его 5-10 лет с момента возникновения первых симптомов. Более доброкачественное течение отмечается при атипичной акинетико-ригидной форме.
Данные лабораторных и функциональных исследований. На ЭЭГ отмечаются диффузные изменения биоэлектрической активности мозга. При компьютерной и МР-томографии выявляются расширение желудочков и так называемое вдавление таламуса, если заболевание связано с поражением его мелких клеток, обнаруживаются признаки атрофии коры большого мозга. Имеются указания на возможность ранней, доклинической диагностики заболевания на основании исследования чувствительности лимфоцитов крови к рентгеновскому облучению.
Диагностика и дифференциальный диагноз. Диагноз может вызывать затруднения в атипичных случаях хореи Гентингтона.
Во всех случаях большое значение имеют семейный характер заболевания, выявление других очаговых симптомов поражения мозга, характер течения заболевания, изменения в цереброспинальной жидкости и другие диагностические критерии.
Дифференцировать хорею Гентингтона следует от хореического синдрома, возникающего при опухолях головного мозга, от сифилиса, энцефалитов, сосудистых заболеваний, а также старческой (сенильной) хореи.
Лечение. Для подавления гиперкинеза назначают антагонисты допамина. Это препараты фенотиазинового ряда – трифтазин (7,5-10 мг в сутки) в сочетании с транквилизаторами, допегитом, резерпином. Попытки лечения больных, страдающих хореей Гентингтона, с помощью стереотаксических операций оказались безуспешными.
24.2.6. Болезнь Фридрейха
Семейная атаксия Фридрейха – наследственное дегенеративное заболевание нервной системы, характеризующееся синдромом поражения задних и боковых канатиков спинного мозга. Тип наследования аутосомно-рецессивный, с неполной пенетрантностью патологического гена. Мужчины и женщины болеют одинаково часто.
Патоморфология. Обнаруживаются дегенеративные изменения в проводящих путях задних и боковых канатиков спинного мозга, преимущественно пучков Голля, в меньшей степени – Бурдаха, Флексига, Говерса, волокнах пирамидного пути, задних корешках, а также в клетках коры мозжечка, подкорковых ганглиев, коры большого мозга.
Клинические проявления. Начало заболевания относится к 6-15-летнему возрасту. Первым симптомом болезни является неустойчивая походка, которая была охарактеризована Шарко как табетически-мозжечковая. В ранних стадиях атаксия выражена преимущественно в ногах. По мере прогрессирования заболевания нарушения координации распространяются на верхние конечности и лицо. При неврологическом обследовании выявляются крупноразмашистый нистагм, атаксия в руках и ногах, адиадохокинез, дисметрия, скандированная речь, расстройства мышечно-суставного чувства и вибрационной чувствительности. Меняется почерк. Ранним симптомом является снижение, а затем угасание сухожильных и периостальных рефлексов. Мышечный тонус понижен. В более поздних стадиях болезни присоединяются афферентный парез нижних, а затем верхних конечностей, нередки патологические пирамидные рефлексы, дистальные мышечные атрофии. Интеллект снижен.
Заболевание медленно прогрессирует. Средняя продолжительность жизни 10-15 лет с момента его развития.
Диагностика и дифференциальный диагноз. Заболевание распознается на основании характерных симптомов – деформаций стоп по типу стопы Фридрейха (высокий свод, экстензия основных фаланг пальцев стопы и флексия концевых фаланг), поражения миокарда, эндокринных расстройств.
Дифференцировать заболевание следует от церебрального сифилиса, рассеянного склероза, фуникулярного миелоза и других форм мозжечковых дегенерации.
Лечение. Применяются симптоматические средства: общеукрепляющие препараты, лечебная физкультура, массаж. В некоторых случаях производится хирургическая коррекция деформации стоп.
24.2.7. Наследственная мозжечковая атаксия Пьера Мари
Мозжечковая атаксия Пьера Мари – наследственное дегенеративное заболевание с преимущественным поражением мозжечка и его проводящих путей. Тип наследования аутосомно-доминантный. Возникает заболевание в возрасте 20 лет и старше.
Патоморфология. Выявляется дегенеративное поражение клеток коры и ядер мозжечка, спиноцеребеллярных путей в боковых канатиках спинного мозга, в ядрах моста и продолговатого мозга.
Клинические проявления. Заболевание проявляется нарушениями функций мозжечка и его связей. Наблюдаются атаксия при выполнении координаторных проб, нарушение походки, скандированная речь, интенционное дрожание, нистагм. Мозжечковые симптомы сочетаются с умеренными или выраженными признаками пирамидной недостаточности (повышение сухожильных и периостальных рефлексов, клонусы стоп), а иногда с глазодвигательными нарушениями (косоглазие, птоз, недостаточность конвергенции). Характерным признаком является в различной степени выраженное снижение интеллекта.
Диагностика и дифференциальный диагноз. Наибольшие трудности возникают при дифференциации наследственной мозжечковой атаксии Пьера Мари и атаксии Фридрейха. Нужно учитывать тип наследования заболевания, возраст, в котором развиваются первые симптомы, характер изменения сухожильных рефлексов (при атаксии Фридрейха они снижены), наличие зрительных и глазодвигательных расстройств при атаксии Пьера Мари, деформации стоп и скелета. Рассеянный склероз в отличие от семейной атаксии Пьера Мари характеризуется ремитирующим течением, большей выраженностью нижнего спастического парапареза, расстройством функций тазовых органов.
Лечение. Симптоматическое.
24.2.8. Оливопонтоцеребеллярные дегенерации
Группа наследственных заболеваний нервной системы, характеризующихся дегенеративными изменениями нейронов мозжечка, ядер нижних олив и моста мозга, в ряде случаев – ядер черепных нервов каудальной группы, в меньшей степени – поражением проводящих путей и клеток передних рогов спинного мозга, базальных ганглиев. Заболевания отличаются типом наследования и различным сочетанием клинических симптомов. По классификации Кенигсмарка и Вайнера различают 5 типов оливопонтоцеребеллярных дегенерации.
Тип I – оливопонтоцеребеллярная дегенерация Менделя. Наследуется по аутосомно-доминантному типу. Течение медленно прогрессирующее. Проявляться может в возрасте от 11 до 60 лет. Клиническая картина складывается из симптомов поражения мозжечка (атаксия, мышечная гипотония, скандированная речь с элементами дизартрии, интенционное дрожание), ядер каудальных черепных нервов (дизартрия, дисфагия), подкорковых ганглиев (гиперкинезы); реже выявляются пирамидные и глазодвигательные симптомы.
Тип II – оливопонтоцеребеллярная дегенерация Фиклера-Винклера. Наследуется по аутосомно-рецессивному типу. Проявляется в возрасте от 20 до 80 лет симптомами поражения мозжечка, преимущественно атаксией в конечностях. Чувствительность и сухожильные рефлексы не изменены. Парезов не наблюдается.
Тип III – оливопонтоцеребеллярная дегенерация с ретинальной дегенерацией. Наследуется по аутосомно-доминантному типу. Возникает в молодом возрасте. Наряду с мозжечковыми и экстрапирамидными симптомами определяется прогрессирующее снижение остроты зрения вследствие пигментной дегенерации ганглиозных клеток сетчатки.
Тип IV – оливопонтоцеребеллярная дегенерация Шута-Хайкмана. Наследуется по аутосомно-доминантному типу. Проявляется в детском и молодом возрасте. Кроме мозжечковых симптомов, выявляется поражение ядер VII, IX, Х и XII пар черепных нервов (паралич лицевого нерва, бульбарные симптомы) и задних канатиков спинного мозга (расстройства мышечно-суставного чувства и вибрационной чувствительности).
Тип V – оливопонтоцеребеллярная дегенерация с деменцией, офтальмоплегией и экстрапирамидными нарушениями. Тип наследования аутосомно-доминантный. Развивается в среднем возрасте. Характеризуется деменцией, прогрессирующей офтальмоплегией, экстрапирамидными и мозжечковыми симптомами.
Дифференцировать оливопонтоцеребеллярные дегенерации следует от наследственной атаксии Фридрейха и Пьера Мари, прогрессирующих форм рассеянного склероза, опухолей мозжечка, ювенильных форм паркинсонизма.
Лечение. Симптоматическое. Проводят курсы неспецифического общеукрепляющего лечения, массаж, лечебную физкультуру.
Дегенеративные заболевания с преимущественным поражением периферических нервов и мышц составляют значительную долю наследственной патологии человека. Диагностика нервно-мышечных заболеваний основана на молекулярно-генетических и электрофизиологических (ЭМГ) исследованиях.
Электронейромиография позволяет подтвердить диагноз и следить за динамикой заболевания. При нейрогенной мышечной патологии можно выявить признаки денервации: потенциалы фибрилляции, положительные острые волны, снижение амплитуды интерференционного потенциала, полифазные потенциалы. При первичной мышечной патологии ЭМГ-картина неспецифична и вариабельна; наиболее характерно снижение амплитуды потенциалов. Показатели скорости проведения импульса (СПИ) при аксонопатиях уменьшены незначительно или находятся на нижней границе нормы. При демиелинизирующих невропатиях СПИ значительно уменьшена. По изменению СПИ и амплитуды потенциалов действия (по чувствительным или смешанным нервам) можно диагностировать туннельные ней- ропатии, а также дифференцировать аксонопатии и миелинопатии. Увеличение латентного периода поздних ответов наблюдается при невропатиях и корешковом синдроме.
Значительную роль в диагностике играют морфологические, иммуногистохимические и электронно-микроскопические методы изучения биоптатов. Состояние мышечных волокон при световой биомикроскопии помогает дифференцировать первичную миогенную атрофию от вторичной денервационной (неврогенной или миелогенной) амиотрофии. Гистохимический анализ биоптатов необходим для обнаружения специфических метаболических дефектов в мышечной ткани. Электронная микроскопия открыла целый класс заболеваний, которые объединены понятием «структурная миопатия».
Лечение. Для многих заболеваний мышц, нервно-мышечных синапсов, периферических нервов и мотонейронов разработано этиологическое и патогенетическое лечение. В остальных случаях терапия направлена на замедление прогрессирования заболевания, продление периода ремиссии и повышение качества жизни больного. Лечение нервно-мышечных заболеваний требует совместных усилий неврологов и реабилитологов. Тактика лечения зависит от тяжести и скорости прогрессирования заболевания.
Рис. 6.1. Внешний вид ребенка 13 лет, получавшего длительную гормональную терапию. Кушингоид
Принципы длительной кортикостероидной терапии
Осложнения зависят от дозы и длительности лечения (рис. 6.1). Основные осложнения: синдром Кушинга, сахарный диабет, остеопороз, активизация туберкулеза, артериальная гипертония, психоз, подверженность инфекциям, язвенная болезнь.
При отмене кортикостероидов возможны 3 вида осложнений. 1. Осложнения, связанные с угнетением функции надпочечни-
ков. Оно развивается при дробном приеме преднизолона в дозе, превышающей 20-30 мг/сут в течение более одной недели. Полное восстановление занимает до одного года. При дозах, приближенных к физиологическим, функция надпочечников обычно остается сохранной, если длительность лечения не превышает 1 мес. После обычных доз кортикостероидов заместительной терапии не требуется.
2. Общие симптомы отмены (анорексия, тошнота, рвота, сонливость, головная боль, лихорадка, миалгия и артралгия, потеря массы) более вероятны после длительной терапии. Лечение симптоматическое, малыми дозами кортизона (10 мг/сут) в течение нескольких недель.
3. Обострение основного заболевания. Это одно из наиболее опасных осложнений при отмене кортикостероидов. Его риск уменьшается при постепенном снижении дозы. При нервно-мышечных заболеваниях чаще всего применяется преднизолон - препарат короткого действия для приема внутрь. Его можно назначать ежедневно (в несколько приемов или однократно утром) или через день (однократно утром). При коротком курсе (менее месяца) схема приема не имеет существенного значения. При длительном лечении дробный ежедневный прием способствует развитию синдрома Кушинга, угнетению функции надпочечников и снижает сопротивляемость инфекциям. При длительном курсе однократный утренний прием суточной дозы препарата короткого действия реже вызывает угнетение над-
почечников (хотя и не предотвращает возникновение синдрома Кушинга). При приеме через день удвоенной суточной дозы реже развиваются угнетение надпочечников, синдром Кушинга и снижение сопротивляемости инфекциям. Эта схема эффективна при большинстве нервно-мышечных заболеваний.
6.1. Прогрессирующие мышечные дистрофии
Термином «мышечные дистрофии» обозначают группу клинически полиморфных генетически детерминированных заболеваний, в основе которых лежат первичные прогрессирующие дегенеративные изменения в мышечных волокнах. Различные формы миодистрофий отличаются друг от друга своей генетической природой, типом наследования, сроком дебюта, топографическим своеобразием распределения мышечных атрофий. К характерному клиническому маркёру миодистрофий относится «утиная» походка, связанная со слабостью ягодичных мышц, которые фиксируют таз относительно бедренной кости. В результате во время ходьбы возникают наклон таза в сторону неопорной ноги (феномен Тренделенбурга) и компенсаторный наклон туловища в противоположную сторону (феномен Дюшенна). Кроме того, у больных можно наблюдать ходьбу на пальцах, частые падения, медленное двигательное развитие и специфические ограничения при поднимании рук вверх, подъеме по лестнице, вставании с пола.
Миодистрофии Дюшенна и Беккера. Форма Дюшенна широко распространена в мире и встречается с частотой 1 на 3500 новорожденных мальчиков, тогда как форма Беккера наблюдается примерно в 3-5 раз реже.
Этиология и патогенез. Миодистрофии Дюшенна и Беккера являются аллельными вариантами, наследуются по рецессивному сцепленному с Х-хромосомой типу и обусловлены либо полным отсутствием синтеза, либо синтезом дефектного высокомолекулярного цитоскелетного белка-дистрофина. Из-за отсутствия дистрофина миофибриллы утрачивают устойчивость к циклическим актам сокращения-расслабления и разрываются. Саркоплазматические мембраны становятся нестабильными, нарушается работа ионных каналов, в результате повышается концентрация свободного внутриклеточного ионизированного кальция, который оказывает некротизирующее влияние на мышечные волокна, вызывая их лизис (рис. 6.2).
Клиническая картина. Первые клинические симптомы у большинства мальчиков с миодистрофией Дюшенна возникают до 3-5 лет жизни: нарушается походка, дети начинают часто падать, утрачивают
Рис. 6.2. Молекулярная организация дистрофина
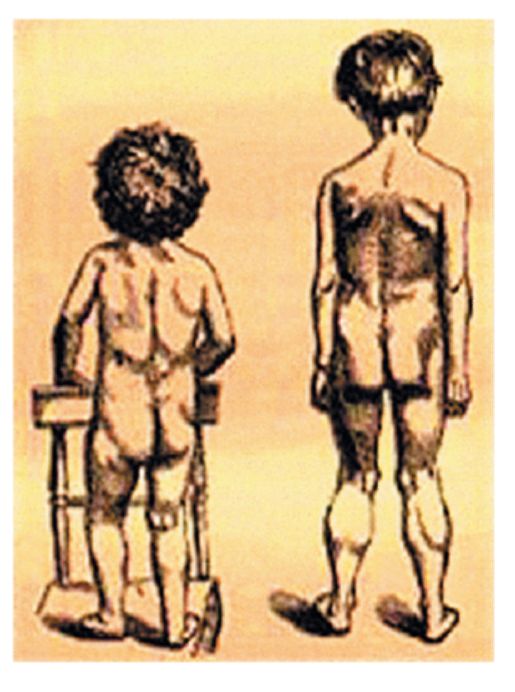
Рис. 6.3. Больные, изображенные Г. Дюшенном
подвижность. Развивающаяся псевдогипертрофия икроножных мышц создает обманчивое впечатление о мышечной силе (рис. 6.3). Псевдогипертрофии могут развиваться также в ягодичных, дельтовидных мышцах, мышцах живота и языка. Наконец, мышечная слабость становится настолько явной, что ребенок с трудом встает с пола, ходит «утиной» походкой, использует миопатические приемы: «взбирание по себе», «подъем лесенкой» (симптомы Говерса).
Рис. 6.4. Ребенок 1,5 года с болезнью Дюшенна
Рис. 6.5. Тот же ребенок в 5 лет. Псевдогипертрофии мышц, лордоз
Двигательные функции относительно стабилизируются между 3 и 6 годами жизни. В большинстве случаев возможность ходить и подниматься по лестнице сохраняется до 8-летнего возраста. От 3 до 8 лет происходит дальнейшее укорочение ахилловых сухожилий и формируются фиксированные сгибательные контрактуры в голеностопных суставах, развиваются компенсаторный поясничный гиперлордоз, кифосколиоз грудного отдела позвоночника, нарастают атрофии мышц бедра, тазового, а затем и плечевого пояса, спины и проксимальных отделов рук. Обращает на себя внимание наличие «свободных надплечий», «крыловидных лопаток», «осиной талии». Нередко атрофии мышц маскируются хорошо развитым подкожным жировым слоем. Часто развиваются деформации грудной клетки и стоп, диффузный остеопороз. Коленные, сгибательные и разгибательные локтевые рефлексы исчезают в первую очередь, тогда как ахилловы рефлексы могут сохраняться довольно долго. В возрасте 9 лет некоторые дети уже передвигаются с помощью кресла-каталки, но у большинства способность к самостоятельному передвижению сохраняется вплоть до 12-летнего, а возможность стоять - до 16-летнего возраста. Слабость дыхательной мускулатуры и диафрагмы обусловливает уменьшение жизненной емкости легких до 20 % нормы, что приводит к эпизодам ночной гиповентиляции (рис. 6.4-6.6).
У части больных обнаруживаются различные признаки эндокринопатии: адипозогенитальный синдром, низкорослость. В связи
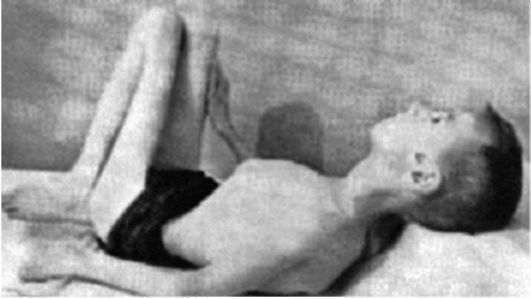
Рис. 6.6. Тот же ребенок в 14 лет. Выражены деформация позвоноч- ника, контрактуры сгибательного характера, атрофии мышц
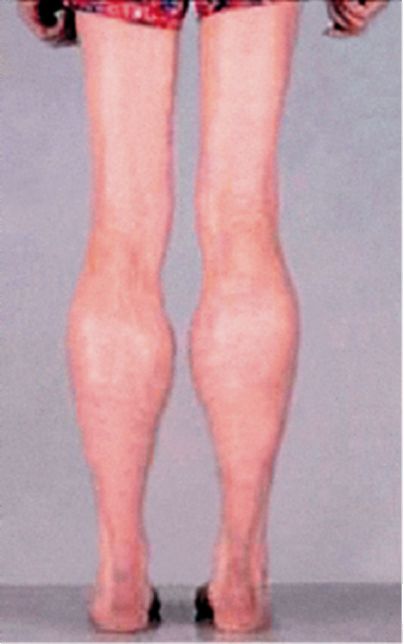
Рис. 6.7. Псевдогипертрофии мышц голеней при болезни Беккера
с дефицитом церебральных изоформ дистрофина - аподистрофинов у части больных с миодистрофией Дюшенна имеет место умственная отсталость различной степени. Тяжесть психических нарушений у детей не соотносится с выраженностью мышечного дефекта и стадией миодистрофического процесса. Облигатным признаком развернутой стадии миодистрофии Дюшенна является гипертрофическая, или дилатационная, кардиомиопатия, которая сопровожда- ется нарушениями ритма сердца, расширением его границ, явлениями сердечной недостаточности. Кардиомиопатия - наиболее частая причина летального исхода при миодистрофии Дюшенна. К летальности приводит также дыхательная недостаточность, которая провоцируется интеркуррентными инфекциями или аспирацией. Больные погибают на 2-3-м десятилетии жизни.
Миодистрофия Беккера (рис. 6.7) может развиваться после 15-
20 лет, протекает гораздо мягче. Больные с этой формой миодистрофии доживают до зрелого возраста. Нарушения интеллекта для нее нехарактерны, ретракции сухожилий и контрактуры менее выражены, чем при миодистрофии Дюшенна, кардиомиопатия может отсутствовать. Однако у некоторых больных нарушения деятельности сердца выступают на первый план и часто являются манифестным симптомом болезни. Кроме того, у части больных миодистрофией Беккера сохранена фертильность, поэтому взрослые больные через дочь могут передавать заболевание своим внукам («эффект деда»).
Диагностика. Для миодистрофии Дюшенна характерно значительное повышение уровня ферментов уже на ранних стадиях миодистро-
фического процесса. У больных до 5-летнего возраста уровень креатинфосфокиназы (КФК) может превышать верхнюю границу нормы в десятки и даже сотни раз. Затем концентрация фермента снижается приблизительно на 20% в год. Содержание в сыворотке альдолазы, лактат-дегидрогеназы, трансаминаз также повышено. Высокая активность КФК - практически облигатный признак болезни и, кроме миодистрофии Дюшенна, может встречаться при миодистрофии Беккера (как правило, не превышая 5000 ЕД/л), полимиозите, дерматомиозите, гипотиреозе, алкогольной миопатии и пароксизмальной миоглобинурии. ЭМГ выявляет признаки первично-мышечного поражения (низковольтажная кривая с обилием полифазных потенциалов, укорочение потенциалов действия двигательных единиц).
В настоящее время общепринятым «золотым стандартом» для диагностики миодистрофии Дюшенна и Беккера, выявления носи- тельства гена и пренатальной диагностики является мутационный анализ. Иммуногистохимическая реакция на дистрофин применяется при анализе процентного содержания дистрофина в мышцах и отличает формы Дюшенна и Беккера (при первой он отсутствует). У гетерозиготных носительниц (матерей и сестер больных) примерно в 70% случаев выявляются субклинические признаки патологии скелетных мышц: повышение КФК, первично-мышечные изменения на ЭМГ и при исследовании мышечных биоптатов. Изредка у носительниц отмечаются уплотнение и увеличение в объеме икроножных мышц, повышенная мышечная утомляемость при физической нагрузке, спазмы в мышцах после нагрузки (крампи).
Рентгенография костей помогает выявить атрофию диафизов длинных трубчатых костей, истончение кортикального слоя, сужение костно-суставного канала, диффузный остеопороз.
Поражение сердечно-сосудистой системы (кардиомиопатия) развивается у 73% больных детей. Недостаточность дистрофина в кар- диомиоцитах приводит к прогрессирующей атрофии кардиомиоцитов и замещению их фиброзной тканью. Кардиомиопатия впервые диагностируется в 6-7 лет, к 20 годам она имеется у 95% больных. Отмечаются также тахикардия, аритмия, лабильность пульса и АД, приглушение тонов, расширение границ сердца. На ЭКГ отмечаются нарушения сердечного ритма, желудочковые экстрасистолы, признаки гипертрофии левого желудочка (27%): глубокий зубец Q в отведениях II-III aVF и V 6 ; высокий R в отведении V 1 , признаки ишемии миокарда (5%). На Эхо-КГ можно выявить гипертрофическую (55%) или дилатационную
(25%) кардиомиопатию, дефект межпредсердной перегородки, пролапс митрального клапана, миксому левого желудочка.
Биопсия сердечной мышцы обнаруживает атрофию мышечных волокон, интерстициальный фиброз, жировую инфильтрацию.
Дифференциальная диагностика миодистрофии Дюшенна и Беккера проводится с врожденной дисплазией тазобедренных суставов, витамин- D-резистентным рахитом, проксимальными типами спинальных амиотрофий, полимиозитом и дерматомиозитом, метаболическими и эндокринными миопатиями.
При наличии клинического фенотипа миодистрофии Дюшенна у девочек следует в первую очередь исключить наличие Х-аутосомных транслокаций или других хромосомных аберраций с заинтересован- ностью Х-хромосомы, а также некоторые другие редкие генетические варианты. Кроме того, требуется исключить синдром Шерешевского- Тернера (Х-моносомия). С этой целью проводят цитогенетическое исследование кариотипа.
Миодистрофия Эмери-Дрейфуса является медленно прогрессирующей формой миодистрофии с X-сцепленным рецессивным типом наследования, которая обусловлена мутацией в гене цитоскелетного мышечного белка - эмерина, продуцирующегося преимущественно в скелетных, гладких мышцах и кардиомиоцитах.
Клиническая картина (рис. 6.8). Заболевание начинается между 5 и 15 годами жизни. Самыми ранними и типичными симптомами являются нарастающие сгибательные контрактуры в локтевых суставах и разгибателях кистей, ретракции ахилловых сухожилий. Как правило, в 12-летнем возрасте у пациентов уже значительно выражены контрактуры в коленных, голеностопных и локтевых суставах. Затем возникают слабость и атрофия двуглавых и трехглавых мышц плеча, позже - дельтовидных и других мышц плечевого пояса. В некоторых случаях в качестве первого симптома отмечают ходьбу на пальцах и наружных краях стоп, которая возникает приблизительно в 5-летнем возрасте. До этого момента двигательное развитие детей обычно не нарушено. Мышечная слабость возникает незаметно и медленно прогрессирует. Примерно в 20-летнем возрасте наступает относительная стабилизация. Способность к ходьбе и подъему по лестнице сохраняется. Лицевая мускулатура не страдает. Слабость мышц представлена в руках (лопаточно-плечевая) и в ногах (перонеальная). Приемы Говерса и псевдогипертрофия икроножных мышц могут отсутствовать. Сухожильные рефлексы не вызываются. Часто укорочены заднешейные мышцы, отмечается ограничение
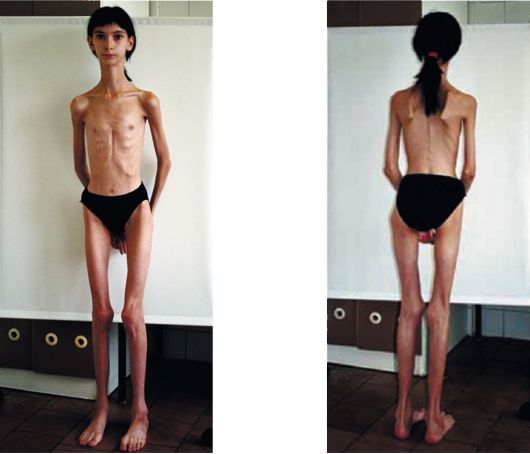
Рис. 6.8. Пациентка 12 лет с миодистрофией Эмери-Дрейфуса
движений в шейном отделе позвоночника (синдром ригидного позвоночника). Частыми и прогностически важными симптомами болезни являются нарушения сердечной проводимости и развивающаяся дила- тационная или гипертрофическая кардиомиопатия. Кардиомиопатия может осложняться развитием паралича предсердий вследствие фиброза пейсмекеров синусового узла. В этих случаях показана срочная имплантация искусственного водителя ритма.
Синкопальные состояния и приступы брадикардии в некоторых случаях могут предшествовать появлению мышечной слабости, но чаще возникают на 3-м десятилетии жизни. Изменения в проводящей системе сердца далеко не всегда обнаруживаются при стандартном ЭКГ-исследовании, но при мониторировании можно выявить атриовентрикулярные блокады и периоды Самойлова-Венкебаха. Аритмия, которую не удается скорригировать имплантацией искусственного водителя ритма, может привести к инсульту и смерти больного. Витальный прогноз при миодистрофии Эмери-Дрейфуса всецело зависит от степени поражения сердца.
Диагностика. Активность КФК повышена умеренно, лактатде- гидрогеназы и альдолазы - в меньшей степени. В пользу миодистрофии Эмери-Дрейфуса свидетельствует отсутствие иммунофлюоресцентной реакции на эмерин с 12 моноклональными антителами при биомикроскопии лейкоцитов, мышечных и кожных биоптатов. Для болезни характерны сочетанные ЭМГ-признаки первично-мышечного и неврогенного поражения с большой представленностью спонтанной денервационной активности.
Лице-лопаточно-плечевая миодистрофия (тип Ландузи-Дежерина). Заболевание наследуется по аутосомно-доминантному типу с высокой пенетрантностью и вариабельной экспрессивностью. Встречается с частотой 2,9 на 100 000 населения. Установлена генетическая гетерогенность лице-лопаточно-плечевой миодистрофии. Большинство случаев связано с мутацией длинного плеча хромосомы 4.
Клиническая картина. Заболевание обычно начинается на 2-м десятилетии жизни. Первоначально атрофии наблюдаются в плечевом поясе, позже распространяются на лицо. У больных обедняется мимика; речь становится неразборчивой. На высоте заболевания поражаются круговые мышцы рта и глаз, большая грудная, передняя зубчатая и нижние отделы трапециевидной мышцы, широчайшая мышца спины, двуглавая и трехглавая мышцы плеча. Отмечаются характерные симптомы в виде «поперечной улыбки» («улыбки Джоконды»), протрузии верхней губы («губы тапира»). Грудная клетка уплощается в переднезаднем направлении, плечевые суставы ротированы внутрь, лопатки приобретают крыловидную форму. Атрофии распространяются в нисходящем направлении. При вовлечении в процесс мышц ног слабость наиболее заметна в перонеальной группе мышц - «свисающая стопа». Характерна асимметрия атрофии. Может наблюдаться псевдогипертрофия мышц. Контрактуры и ретракции сухожилий выражены умеренно. Кардиомиопатия редка. Аномалии сосудов сетчатки при ангиоретинографии рассматривают как одно из фенотипических проявлений болезни. Тяжелые глазные симптомы сопровождаются теле- ангиэктазией, отеком и отслойкой сетчатки. Может наблюдаться снижение слуха. Телеангиэктазии ликвидируют коагуляцией, что предотвращает развитие слепоты. Течение болезни относительно благоприятно. Физические перегрузки, интенсивные спортивные занятия и нерационально проводимая лечебная физкультура могут способствовать более тяжелому течению болезни. Многие больные
сохраняют работоспособность, и качество их жизни не ухудшается. Других больных болезнь приковывает к креслу-каталке в зрелом возрасте.
Диагностика. Уровень КФК может повышаться в 5 раз. При ЭМГ регистрируются как миопатические двигательные единицы, так и денервационные потенциалы. Во многих мышцах конечностей гистологические изменения минимальны; в надлопаточных мышцах обнаруживают прогрессирующую дегенерацию и краевую денервацию. Необходимо исключить миастению и опухоль мозгового ствола.
Конечностно-поясные миодистрофии (КПМД) - случаи проксимальной мышечной слабости, которая начинает развиваться на 2-м или 3-м десятилетии жизни, медленно прогрессирует и приводит к глубокой инвалидизации лишь через 15-20 лет.
Этиология и патогенез. КПМД не является однородной в генетическом отношении; на сегодняшний день обнаружено около 10 различных генетических дефектов.
Клиническая картина. Первыми поражаются мышцы плечевого и тазового пояса. В развернутых стадиях значительно поражаются мышцы спины и живота, формируется поясничный гиперлордоз. Мышцы лица, как правило, не страдают. У больных обнаруживаются типичная «утиная» походка, миопатические приемы. Контрактуры и псевдогипертрофии мышц нехарактерны. Кардиомиопатии не развиваются; интеллект сохранен. Мужчины и женщины поражаются одинаково часто. Летальный исход может наступать от легочных осложнений.
Диагностика. Содержание КФК умеренно повышено. ЭМГ демонстрирует признаки первично-мышечного поражения. КПМД необходимо отличать от миопатии Беккера, ювенильной спинальной амиотрофии, миопатии с накоплением гликогена, эндокринных, токсических, лекарственных миопатий, полимиозита и миозита.
6.2. Врожденные структурные миопатии
Врожденные структурные миопатии (ВСМ) представляют собой генетически гетерогенную группу медленно прогрессирующих заболеваний скелетных мышц. Клиническая симптоматика различных ВСМ неспецифична. Основной клинический симптом - диффузная мышечная гипотония, которая может возникать еще внутриутробно и определять редкое шевеление плода. ВСМ принадлежит значительный удельный вес среди причин так называемого синдрома вялого ребенка. Гипотония превалирует в мышцах тазового пояса и прок-
симальных отделов ног. Мышцы плечевого пояса и рук поражаются в меньшей степени. Нередко выявляются врожденный вывих бедра, долихоцефалическая форма головы, готическое нёбо, конская стопа, кифосколиоз, гипоплазия мышц. Характерна задержка двигательного развития: дети поздно начинают держать голову, сидеть, вставать, ходить, часто падают при ходьбе, неспособны бегать. В дальнейшем они не могут выполнить простейших гимнастических упражнений, участвовать в подвижных играх. Сухожильные рефлексы у больных могут быть нормальными, сниженными или отсутствовать. Чрезвычайно важным критерием ВСМ является отсутствие прогрессирования или очень медленное нарастание мышечной слабости. При некоторых формах двигательные функции с возрастом могут несколько улучшаться.
Диагностика. Активность КФК в норме или чуть повышена. При ЭМГ регистрируются низкоамплитудные полифазные миопатические потенциалы двигательных единиц. Скорость проведения импульса по двигательным и чувствительным волокнам в норме. Диагноз достоверно устанавливается лишь при проведении мышечной биопсии с использованием световой и электронной микроскопии, кото- рая обнаруживает специфическое строение мышечного волокна. Исследование мышечных биоптатов у больных детей может выявить уникальные гистологические признаки, определившие целый ряд наименований: болезнь центрального стержня, миотубулярная миопатия, немалиновая миопатия, трехпластинчатая миопатия, миопатия с лизисом волокон I типа, миопатия со сферическими тельцами, миопатия с накоплением телец в виде «отпечатков пальцев», миопатия с цитоплазматическими включениями в виде редуцированных телец, миопатия с агрегацией трубочек и т.д.
Лечение мышечных дистрофий. Терапевтические возможности при миодистрофиях значительно ограничены. Этиологического и патогенетического лечения практически не существует. Симптоматическое лечение направлено на как можно более длительное поддержание имеющейся мышечной силы, снижение темпа развития атрофии и предотвращение формирования контрактур. Основная задача состоит в том, чтобы на максимально возможный срок продлить период активности.
Комплексное лечение состоит из медикаментозной терапии, физиотерапевтических процедур, лечебной гимнастики и массажа, ортопедической коррекции и соблюдения диеты. Важную роль играют психологическая поддержка, продолжение обучения, правильная профессиональная ориентация.
Физиотерапевтические процедуры включают электрофорез прозерина, хлорида кальция, синусоидально-модулированные или диадинамические токи различной проникающей способности, электромиостимуляцию, озокеритовые, парафиновые и грязевые аппликации, ванны (радоновые, хвойные, серные, сероводородные). Рекомендуется оксибаротерапия, поскольку кислород ингибирует процессы фиброзирования и коллагенообразования. Ортопедическая коррекция консервативного (специальные шины и укладки) и оперативного характера (ахиллотомия, миотомия) направлена на борьбу с контрактурами и формирующимися патологическими установками конечностей и также имеет цель сохранить способность больного к самостоятельному передвижению. В каждом случае необходимо индивидуально взвесить предполагаемую пользу и возможный вред от оперативного вмешательства. При развивающихся контрактурах после проведения тепловых процедур рекомендуется осторожное растяжение мышц до 20-30 раз в день с последующим наложением шины на время сна.
Больному рекомендуется диета, обогащенная белком, с ограничением жиров (особенно животного происхождения) и углеводов при оптимальном и сбалансированном содержании витаминов и микроэлементов. Необходимо избегать соленого, жареного, пряностей, маринадов, крепких мясных бульонов, кофе, шоколада, какао, пирожных, сдобного теста.
Медикаментозная терапия преследует цель компенсировать энергетический дефицит в мышечной ткани, улучшить тканевый метаболизм и кровообращение, стабилизировать мембраны мышечных волокон. Применяют никотиновую кислоту, витамины В 6 , В 12 , А и Е (аевит). Для улучшения белково-синтетических процессов используют аминокис- лотные препараты (церебролизин, глицин, метионин, глутаминовую, фолиевую кислоты). Назначают нестероидные анаболические средства (калия оротат), макроэргические препараты (фосфаден), кардиотрофики (рибоксин, карнитина хлорид, солкосерил), средства, улучшающие периферическое кровообращение (трентал, галидор, теоникол, оксибрал) и ноотропы [пантогам, пирацетам (ноотропил)]. Для улучшения энергетических процессов, происходящих в системе дыхательной цепи митохондрий, используют коэнзим Q10 (убихинон), лимантар, внутривенные инфузии цитохрома-С. Эффекты дезинтоксикации и улучшения реологических свойств крови, купирование слайдж-синдрома достигаются инфузиями вазоактивных препаратов, реополиглюкина, курсов плазмафереза. Относительной стабилизации клеточных мембран способствуют малые дозы преднизолона. Для коррекции
кардиомиопатии используют кардиотрофики (кроме больных с гипертрофической кардиомиопатией); при сердечной недостаточности - сердечные гликозиды, диуретики, каптоприл. При сердечных аритмиях назначают хинидин, β-адреноблокаторы, антагонисты кальция. При развитии полной атриовентрикулярной блокады актуальным становится вопрос о целесообразности имплантации искусственного электрокардиостимулятора.
Перспективы разработки методов генетической терапии при некоторых миодистрофиях (болезнях Дюшенна, Беккера) связаны с совершенствованием генетических технологий. Идет активный поиск генети- ческих носителей (векторов), способных встроить ген дистрофина или мини-гены в мышечные клетки больного реципиента. Исключительное значение придается медико-генетическому консультированию семьи, проведению пренатальной диагностики с исследованием ДНК плода.
6.3. Спинальные мышечные амиотрофии
Спинальные мышечные амиотрофии (СМА) - это гетерогенная группа наследственных заболеваний периферической нервной системы. Патогенез связан с прогрессирующей дегенерацией мотонейронов передних рогов спинного мозга (в некоторых случаях и двигательных ядер ствола мозга). Причиной этого является генетический дефект, вызывающий программируемую клеточную гибель - апоптоз клеток. Утрата мотонейронов приводит к развитию вялого паралича и денервационной атрофии поперечнополосатых мышц. В большинстве случаев наблюдается симметричное поражение проксимальных мышц конечностей; дистальные амиотрофии, поражение буль-
барной мускулатуры и асимметрия поражения развиваются реже. Центральный мотонейрон, как правило, интактен. Расстройств чувствительности не бывает.
Разные варианты СМА отличаются возрастом дебюта, характером течения, топографией поражения скелетной мускулатуры и типом наследования (рис. 6.9). Большинство форм наследуется по аутосомно-рецессивному типу. Несколько форм характеризуются
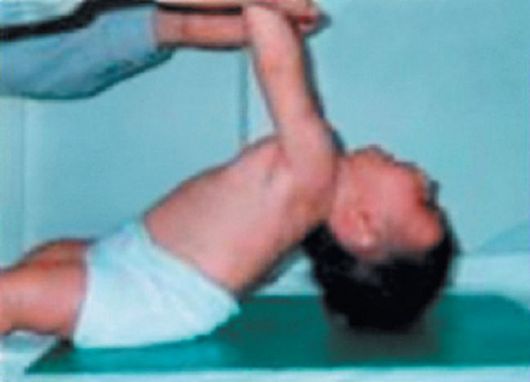
Рис. 6.9. Синдром вялого ребенка при СМА
аутосомно-доминантным и Х-сцепленным рецессивным типами наследования. При гистологическом исследовании мышечных биоптатов выявляют, что к группам волокон обычного размера прилежат мышечные волокна малого размера, пучки гипертрофированных и атрофичных мышечных волокон.
Если ЭМГ определяет бесспорные симптомы СМА, проведение мышечной биопсии необязательно. Принципы лечения и реабилитации СМА такие же, как при миодистрофиях. Этиотропное и патогенетическое лечение пока не разработано.
Проксимальные спинальные амиотрофии детского возраста наследуются по аутосомно-рецессивному типу. Выделяют три фенотипи- чески различных варианта, отличающихся возрастом клинической манифестации, течением и прогнозом:
• тип I, или острая злокачественная инфантильная СМА Верднига- Гоффмана;
• тип II, или хроническая инфантильная СМА (промежуточный тип);
• тип III, или ювенильная СМА Кугельберга-Веландера.
В их основе лежит единая генетическая мутация - делеция гена жизнеспособности моторного нейрона, расположенного на длинном плече хромосомы 5. Поиск мутации проводят при ДНК-диагностике, в том числе у плода при пренатальной диагностике, которая помогает избежать рождения больного ребенка.
Острая злокачественная инфантильная спинальная амиотрофия (болезнь Верднига-Гоффмана, или СМА I типа) встречается с частотой 1 на 25 500 новорожденных. Клинические симптомы отмечаются уже при рождении или появляются до 6 мес жизни. Еще внутриутробно отмечается вялое шевеление, свидетельствующее о снижении двигательной активности плода. У больного ребенка обнаруживают генерализованную слабость, преимущественно в проксимальных мышечных группах, гипотонию и арефлексию. В положении на спине наблюдается «поза лягушки» с разведением и наружной ротацией бедер. Мимическая мускулатура относительно сохранна, глазодвигательные мышцы не вовлечены. Дыхательная функция поначалу адекватная. Выявляются атрофия и фасцикуляции в языке, фасцикулярный тремор кистей. При развитии бульбарного синдрома исчезает глоточный рефлекс, значительно затрудняется кормление, что может привести к аспирационной пневмонии. Часто формируется деформация грудной клетки (рис. 6.10). Если мышечная слабость
Рис. 6.10. Ребенок, 6 мес, с болезнью Верднига-Гоффмана
выявляется сразу после рождения, то смерть наступает приблизительно в 6-месячном возрасте, тогда как при появлении первых симптомов после 3 мес жизни срок выживаемости может составлять около 2 лет. Основная причина смерти - дыхательная недостаточность на фоне интер- куррентных респираторных заболеваний (рис. 6.11, 6.12).
Для диагностики выявляют мутацию гена путем молекулярно-генетического анализа. Концентрация КФК обычно в норме, но у детей с быстро прогрессирующей слабостью она может быть несколько повышена. ЭМГ обнаруживает потенциалы фибрилляций и фасцикуляции в покое и повышение средней амплитуды потенциалов двигательных единиц. Скорость проведения по двигательным аксонам периферических нервов, как правило, соответствует норме. СМА I типа необходимо дифференцировать от других состояний, вызывающих синдром «вялого ребенка». К ним относятся врожденные миодистрофии и невропатии, структурные миопатии, врожденная или неонатальная миастения, метаболические миопатии, внутриутробный полиомиелит, ботулизм, хромосомная патология, атоническая форма церебрального паралича, синдром Марфана.
Хроническая инфантильная спинальная амиотрофия (СМА II типа). Мышечная слабость, как правило, появляется между 6-м и 24-м мес жизни. Чем раньше дебютируют симптомы, тем злокачественнее течение. Первоначальные проявления слабости обычно симметричны и наблюдаются в проксимальных мышечных группах конечностей. Слабость мышц бедер - наиболее заметный симптом. В раннем периоде дистальная мышечная слабость минимальна или отсутствует. Сухожильные рефлексы с пораженных мышц резко снижены. Все больные способны сидеть, большинство - самостоятельно стоять, а некоторые даже могут ходить (рис. 6.13). Мимическая мускулатура
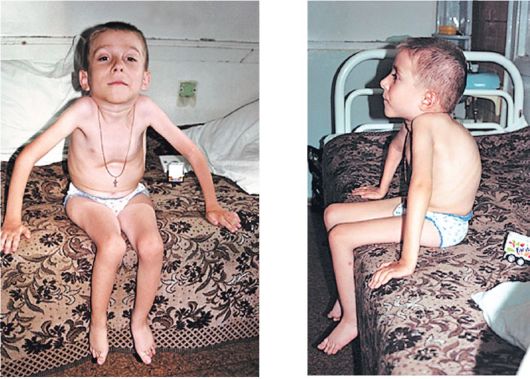
Рис. 6.11. Мальчик, 5 лет, с болезнью Верднига-Гоффмана
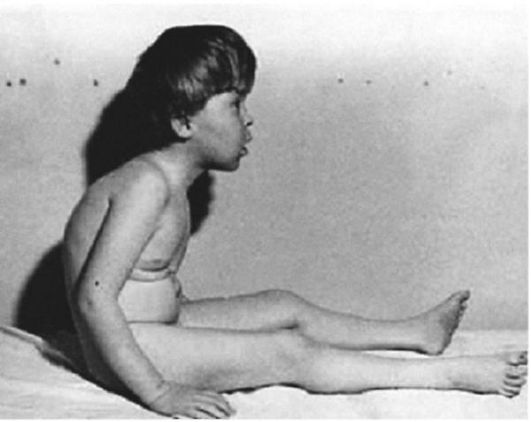
Рис. 6.12. Мальчик, 3 лет, с болезнью Верднига-Гоффмана
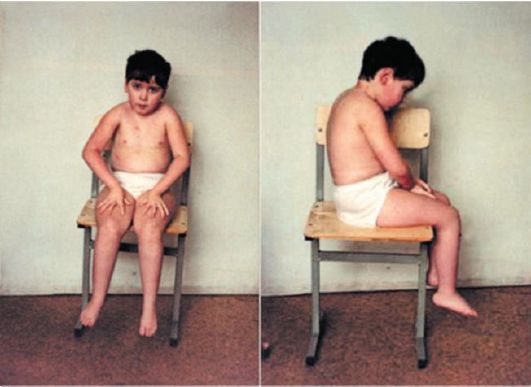
Рис. 6.13. Девочка, 9 лет, с болезнью Кугельберга-Веландера
и наружные мышцы глаза на ранних этапах болезни не поражаются. Мышечная слабость прогрессирует медленно. В отдельных случаях она остается стабильной многие годы, а затем прогрессирование воз- обновляется. Предполагается выживание больных вплоть до зрелого возраста, но даже в период относительной стабилизации ЭМГ выявляет
потенциалы фибрилляций и фасцикуляций. Формируются контрактуры, эквиноварусная деформация стоп. Уже в грудном возрасте у детей наблюдаются искривление позвоночника, деформации грудной клет- ки, дисплазия тазобедренных суставов.
Диагностика. Концентрация КФК в норме. Результаты генетического анализа и данные ЭМГ те же, что и при острой инфантильной форме.
Ювенильная спинальная амиотрофия (болезнь Кугельберга-Веландера, или СМА III типа) встречается в общей популяции с частотой 1,2 на 100 000. Двигательная активность во внутриутробном периоде достаточна; при рождении ребенок здоров. Дебют симптомов происходит между 2-м и 15-м годом жизни. Дети начинают неустойчиво ходить из-за нарастающей проксимальной мышечной слабости в ногах. Развиваются псевдогипертрофии икроножных мышц, что часто ведет к ошибочной диагностике миодистрофии Дюшенна. Заболевание течет доброкачественно, прогрессирует очень медленно. Кисти поражаются позже. Лицевые мышцы могут быть ослаблены, но движения глазных яблок всегда в полном объеме. Бульбарные нарушения нехарактерны. Примерно у половины больных могут развиваться костные деформации, изредка - сухожильные ретракции и контрактуры в суставах. Сухожильные рефлексы с ослабленных мышц отсутствуют или значительно угнетены. Часто регистрируется фасцикулярный тремор кистей.
Диагностика. Первостепенное значение имеет выявление генетической мутации. Концентрация КФК может превышать верхнюю границу нормы в 2-4 раза. У половины больных при ЭМГ регистрируется спонтанная активность (фасцикуляции, фибрилляции и положительные острые волны). При напряжении мышц отмечаются повышение амплитуды и полифазия, увеличение длительности и снижение числа потенциалов двигательных единиц. Проведение по чувствительным волокнам нервов всегда в норме. Скорость проведения по двигательным волокнам при длительном течении заболевания может уменьшаться. СМА III типа дифференцируют с конечностнопоясными миодистрофиями.
Бульбоспинальная амиотрофия Кеннеди - редкая Х-сцепленная рецессивная форма СМА, дебютирующая на 4-й декаде жизни; изредка отмечаются случаи дебюта симптомов в 12-15 лет. Ген картирован на длинном плече Х-хромосомы. Мутация затрагивает ген андрогенового рецептора, в том числе спинальных мотонейронов, что делает эти
рецепторы нечувствительными к влияниям мужских половых гормонов (андрогенов). Ядро клинической картины составляют слабость, атрофии и фасцикуляции в проксимальных мышечных группах конечностей, сухожильная арефлексия, лицевая слабость, атрофии и фасцикуляции в языке, периоральные фасцикуляции, дизартрия и дисфагия, тремор и болезненные мышечные спазмы (крампи). Изредка развивается аксональная невропатия. Бульбарные наруше- ния возникают, как правило, спустя 10 лет после начала болезни. Характерны эндокринные нарушения: гинекомастия, тестикулярная атрофия, снижение потенции и либидо, сахарный диабет, бесплодие, обусловленное азооспермией. Прогноз болезни в целом благоприятен: сохраняются способность к ходьбе и возможность самообслуживания. Продолжительность жизни не уменьшается, однако повышен риск возникновения злокачественных новообразований вследствие гормонального дисбаланса (в том числе рака грудной железы).
Диагностика. В настоящее время возможно проведение прямой ДНК-диагностики, установление гетерозиготного носительства и осуществление дородовой диагностики. ЭМГ выявляет признаки денервации. Уровень КФК может быть в норме. Заболевание необходимо отличать от бокового амиотрофического склероза.
6.4. Множественный врожденный артрогрипоз
Множественный врожденный артрогрипоз - синдром, основным проявлением которого является ограничение подвижности в суставах в сочетании с их деформациями. Обычно поражаются дистальные суставы (голеностопные, лучезапястные), реже - коленные и локтевые суставы. Мышечная слабость при артрогрипозе может носить как неврогенный, так и миогенный характер. Подавляющее большинство случаев относится к спорадическим, остальные случаи наследуются по аутосомно-рецессивному или X-сцепленному типу. При неврогенном артрогрипозе наиболее активная фаза болезни наблюдается во внутриутробном периоде и уже в периоде новорожденности нарушены дыхание и глотание; часть детей погибает от аспирации. В более легких случаях выживаемость выше, а мышечная слабость прогрессирует очень медленно или не прогрессирует вообще. Дыхательные расстройства и проблемы с кормлением в дальнейшем исчезают. Контрактуры представлены как в проксимальных, так и в дистальных суставах. У некоторых новорожденных определяются сопутствующие микрогнатия, высокое нёбо, лицевые аномалии, как при
синдроме Эдвардса (трисомии 18). У некоторых детей с неврогенным артрогрипозом обнаруживаются аномалии развития переднего мозга. Бывают сочетания с менингомиелоцеле, микроцефалией и задержкой психического развития. Синдром миогенного артрогрипоза может наблюдаться при миопатии с диспропорцией типов волокон, врожденных миодистрофиях, миотонической дистрофии, миастенических синдромах, дефиците фосфофруктокиназы.
Диагностика. Гистологическое исследование мышц выявляет характерные признаки денервации и реиннервации. Также выявляют проявления миопатии: повышение доли коллагеновых волокон и жировой ткани, хаотичность расположения волокон среднего размера, фиброз капсул мышечных веретен.
6.5. Воспалительные миопатии
Дерматомиозит является системной иммунозависимой ангиопатией, при которой наблюдаются сосудистые окклюзии и инфаркты, приводящие к развитию всех характерных патологических изменений в мышцах, соединительной ткани, коже, желудочно-кишечном тракте и нервных волокнах. Патогенез связан с образованием антител и иммунных комплексов и активацией системы комплемента. В состав периваскулярного инфильтрата входят Т-лимфоциты, которые в подавляющей своей части являются Т-хелперами, В-лимфоциты и плазматические клетки.
Клиническая картина. Пик заболеваемости приходится на возраст 5-10 лет, но описаны случаи и более раннего начала (до 4-месячно- го возраста). Симптомы возникают постепенно или молниеносно. Скрытое начало характеризуется лихорадкой, недомоганием и утратой аппетита (анорексией). Мышечная слабость в это время может отсутствовать. Такие неспецифические симптомы сохраняются в течение недель и месяцев, что наводит на мысль о персистирующей инфекции. У большинства детей дерматит появляется раньше миозита. Сыпь вначале локализуется на верхних веках и имеет вид
эритемы с очагами нарушенной пигментации и отеком. Затем она распространяется вокруг глаз и на область щек. Эритема и отек на разгибательных поверхностях межфаланговых, локтевых и коленных суставов развиваются позже. Со временем кожа становится атрофичной и шелушащейся. Миопатические изменения включают проксимальную слабость, мышечную ригидность и боль. Слабость нарастает, быстро развиваются сгибательные контрактуры и деформации суставов. Сухожильные рефлексы снижаются, а затем исчезают. У 60% больных обнаруживаются кальцификаты в подкожной клетчатке, особенно под теми областями кожи, где нарушена пигментация. Множественные кальцификаты создают эффект «брони» при рентгенографии. У некоторых детей ведущим начальным симптомом является мышечная ригидность, а кожные и миопатические симптомы выражены не столь ярко. Инфаркты желудочно-кишечного тракта в терминальных стадиях болезни в прошлом приводили к смерти. Летальность при дерматомиозите в настоящее время снизилась и составляет менее 5%, что связано с совершенствованием методов лечения. Более чем у 30% взрослых с дерматомиозитом в дальнейшем выявляются злокачественные новообразования.
Диагностика. Сочетание лихорадки, сыпи, миалгии и слабости свидетельствует в пользу диагноза дерматомиозита. В начале болезни уровень КФК обычно повышен. Во время активного дерматомиозита ЭМГ покоя выявляет фибрилляции и положительные острые волны; при мышечном напряжении регистрируются укороченные низкоамплитудные полифазные потенциалы. Мышечная биопсия обнаруживает атрофию миофибрилл. Капиллярные некрозы вначале возникают по периферии мышечного пучка и вызывают ишемию прилежащих миофибрилл. Наиболее выражена атрофия в пучках, которые соприкасаются с большими фасциальными футлярами. Волокна I и II типов (тонические и фазические) поражаются в равной степени.
Лечение. Воспалительный процесс активен в течение 2 лет. Кортикостероиды снижают его активность, способствуя уменьшению симптоматики. Наилучшие результаты достигаются, когда кортикостероиды назначают на ранних стадиях болезни, в высоких дозах и применяют длительно. Препаратом выбора служит преднизолон. Начальная его доза дается из расчета 2 мг/кг в сутки, но не выше 100 мг/сут. Температура тела часто нормализуется в течение первых 48 ч от момента начала терапии. Иногда уровень КФК возвращается
к норме на 2-й нед лечения параллельно с заметным увеличением силы мышечного сокращения. В этом случае дальнейший прием преднизолона может осуществляться по схеме через день и в той дозе, которая позволит снизить тяжесть побочных эффектов стероидной терапии. Терапия преднизолоном одинаково эффективна при приеме препарата ежедневно или по схеме через день, но только в тех случаях, когда лечение не прерывается. Когда сила мышц нарастает, начальную дозу принимаемого через день преднизолона можно снижать на 10% в месяц в течение 5 мес. Дальнейшее уменьшение дозы преднизолона допустимо лишь на 5% в месяц. При решении вопроса о снижении дозы кортикостероидов недопустимо ориентироваться лишь на снижение активности КФК, поскольку заметное увеличение мышечной силы наступает только через 1-2 мес после уменьшения уровня фермента, т.е. ведущим критерием снижения дозы кортикостероидов служит позитивная клиническая динамика. У большинства больных поддерживающая доза преднизолона, принимаемого по схеме через день, которая необходима для нормализации силы мышечного сокращения и концентрации КФК, составляет 25% стартовой дозы.
При лечении преднизолоном у некоторых больных сыпь полностью исчезает, но у большинства остаются рубцовые изменения кожи. Длительная стероидная терапия требует контроля функции желудочно-кишечного тракта. Для защиты слизистой оболочки желудка назначают препараты хлорида калия и блокаторов Н 2 -рецепторов. Серьезным осложнением длительной терапии является развитие стероидной миопатии, которая может быть расценена как обострение основного заболевания. Отличить развивающуюся стероидную миопатию от обострения дерматомиозита по клиническим критериям довольно сложно. При стероидной миопатии, как правило, страдают проксимальные отделы конечностей, развиваются выраженные атрофии, активность КФК не увеличивается. У большинства детей с дерматомиозитом при лечении уже через 3 мес отмечается улучшение, но терапию преднизолоном необходимо продолжать в течение 2 лет. Если лечение прервано преждевременно, неизбежны рецидивы, развиваются кальциноз и контрактуры. Медикаментозное лечение дополняют физической реабилитацией, необходима дыхательная гимнастика. Массаж в активной фазе противопоказан. При правильном лечении благоприятный исход наблюдается у 80% детей с дермато- миозитом. При резистентности или непереносимости преднизолона
показано пероральное назначение цитостатиков: метотрексат в дозе от 10 до 20 мг/м 2 поверхности тела 2 раза в неделю или азатиоприн в дозе 50-150 мг/сут. Во время терапии необходим регулярный контроль за функцией печени и клеточным составом крови. Комбинация кортикостероидов и цитостатиков позволяет избежать длительной терапии преднизолоном в высоких дозах. В случаях, когда прием кортикостероидов ограничен их побочным действием, применяют плазмаферез или курс внутривенных инфузий иммуноглобулина. В неактивной стадии обострений обычно не возникает.
Полимиозит. Этиология в большинстве случаев остается неиз- вестной. Предполагается, что в патогенезе играют роль клеточные и гуморальные механизмы, что подтверждается нередким развитием заболевания на фоне аутоиммунных процессов (системная красная волчанка, узелковый периартериит, ревматоидный артрит, склеродермия), а также хорошим эффектом применения кортикостероидов и иммуносупрессоров. Патогенез связан с клеточно-опосредованной цитотоксической реакцией, реализуемой Т-лимфоцитами, сенсибилизированными к поверхностным антигенам мышечных волокон.
Клиническая картина. Полимиозит обычно возникает в зрелом возрасте (45-55 лет), у детей и подростков встречается редко и не связан со злокачественными новообразованиями. Постепенно, исподволь нарастает симметричная проксимальная мышечная слабость, лихорадка и миалгии нетипичны. Часто развивается слабость сгибателей шеи («свисающая голова»). Для заболевания характерны дисфагия и приступы удушья. Постепенно слабость распространяется и на дистальные отделы конечностей. Выраженность парезов варьирует, а в тяжелых случаях развивается тетраплегия. Изредка слабость ограничивается дистальными группами мышц, мышцами глаза или лица. У больного могут наблюдаться периоды стабилизации и даже ремиссии, что может приводить к ошибочной диагностике конечностно- поясной миодистрофии. При хроническом течении болезни постепенно нарастают мышечные атрофии; возможно формирование контрактур. Сухожильные рефлексы вызываются на ранних стадиях болезни и снижаются при уменьшении мышечной массы, но полностью никогда не исчезают. Этот важнейший дифференциально- диагностический признак позволяет исключить полиневропатию. Иногда заболевание начинается остро с общего недомогания; резкая мышечная слабость развивается в течение нескольких дней, появляются боли в мышцах плечевого пояса. Атрофии мышц очень легкие
или отсутствуют. Часто при рентгенографии в мышцах обнаруживают кальцификаты. У взрослых типичны сердечно-легочные осложнения, нехарактерные для детской формы болезни.
Диагностика. Изменения КФК редки. ЭМГ-исследование практически всегда выявляет типичные признаки и миопатического, и неврогенного процессов. Мышечная биопсия обнаруживает различные патологические отклонения. Гистологически периваскулярная воспалительная инфильтрация наблюдается не всегда, поэтому отсутствие клеточных инфильтратов в образцах биоптатов не исключает диагноз полимиозита.
Для лечения полимиозита используется такая же схема, как при дерматомиозите. Больным, которые резистентны к кортикостерои- дам, показаны цитостатики (метотрексат). Плазмаферез и внутривенные введения иммуноглобулина являются оправданными альтернативными методами лечения при недостаточной эффективности общепринятой терапии.
Острый инфекционный миозит возникает после перенесенного гриппа или другой респираторно-вирусной инфекции. Симптомы вирусной инфекции сохраняются от 1 до 7 дней, а затем появляется интенсивная симметричная боль и слабость в мышцах. В тяжелых случаях за 1 сут больной становится обездвиженным. На фоне общей слабости проксимальные мышечные группы поражены тяжелее, чем дистальные. Болезненна пальпация мышц. Сухожильные рефлексы сохраняются. Уровень КФК обычно более чем в 10 раз превышает верхнюю границу нормы. Почти немедленно вслед за развитием миозита наблюдается его спонтанное обратное развитие. В худшем варианте для исчезновения болевого синдрома требуется от 2 до 7 дней постельного режима, после чего больной полностью выздоравливает.
Миотония. Феномен миотонии представляет собой замедленную реакцию расслабления (релаксации) мышцы после ее сокращения. Выделяют миотонию действия, перкуссионную или механическую миотонию и электромиографическую миотонию.
В патогенезе миотонии играет роль нестабильность мембраны мышечного волокна, что приводит к повторным сокращениям мышцы в ответ на одиночный раздражитель. Повторные миотонические импульсы возникают не спонтанно, а всегда при внешнем воздействии или в результате произвольного сокращения. Миотонию действия можно наблюдать у больного после интенсивного сокращения мышцы. Больного просят, например, сильно сжать кисть в
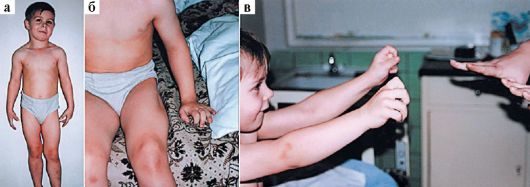
Рис. 6.14. :
а - псевдогипертрофия мыщц; б - мышечный валик при миатонической
реакции; в - невозможность расслабить кисти при повторных движениях
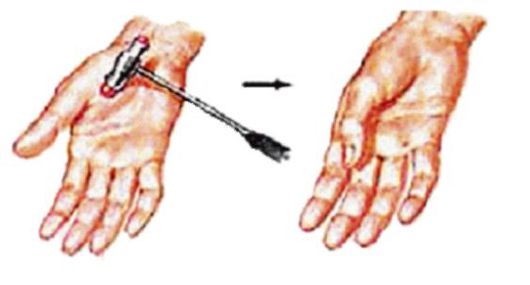
Рис. 6.15. Миотонические феномены у ребенка с миотонией Томсена
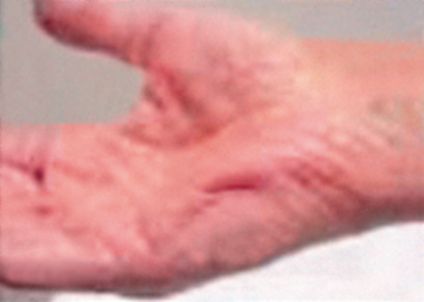
Рис. 6.16. Миотонические феномены у ребенка с миотонией Томсена
кулак и затем быстро его разжать (рис. 6.14-6.16). При этом возникает определенная временная задержка, прежде чем кисть полностью раскроется. При повторном выполнении такого же задания миотонический феномен с каждым разом уменьшается и в конечном итоге исчезает. При врожденной парамиотонии наблюдается обратное явление - нарастание миотонии при повторных движениях (парадоксальная миотония). Перкуссионная миотония проявляется мышечным сокращением после механической стимуляции (быстрый и энергичный удар молоточка по мышце). Этот феномен может наблюдаться в любой мышце, однако наиболее впечатляюще он выглядит при ударе по мышцам тенара: возникает быстрое сгибание и приведение к ладони большого пальца, которое продолжается несколько секунд. При перкуссии крупных мышц возникают симптомы «валика» и «ровика»; при поперечной перкуссии языка образуется «перетяжка» или «ямка» языка. Электромиографическая миотония регистрируется при введении в мышцу игольчатого
Рис. 6.17. ЭМГ при миотонии, «гул пикирующего бомбардировщика»
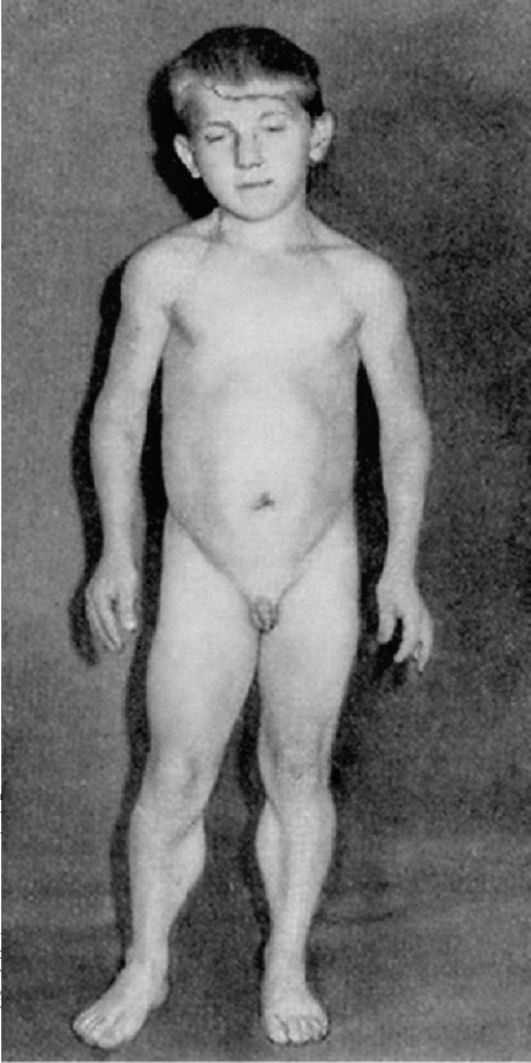
Рис. 6.18. Миотония Томсена у ребенка. «Геркулесовы мускулы»
электрода. Активное напряжение мышцы или ее перкуссия вызывает появление высокочастотных повторяющихся разрядов, которые вначале увеличиваются по частоте (от 100 до 150 Гц) и амплитуде, а затем уменьшаются. Общая продолжительность таких разрядов около 500 мс, а звуковой эквивалент напоминает гул пикирующего бомбардировщика (рис. 6.17).
Феномен миотонии является важнейшим симптомов нескольких гетерогенных наследственных заболеваний (рис. 6.18, 6.19).
Миотоническая дистрофия, или болезнь Россолимо-Куршмана- Штейнерта-Баттена, является мультисистемным заболеванием, которое наследуется по аутосомнодоминантному типу с вариабельной пенетрантностью патологического гена. Этиология болезни связана с нестабильностью участка ДНК хромосомы 19, что выражается в патологической его амплификации (повторяемости). В результате увеличивается число копий этого гена от 50 до нескольких тысяч. Миотоническая дистрофия с полным правом может быть отнесена к классу так называемых болезней экспансии нуклеотидных триплетов. Число повторов возрастает в последующих поколениях и коррелирует с более тяжелым течением заболевания (феномен антиципации). Количество повторов у ребенка
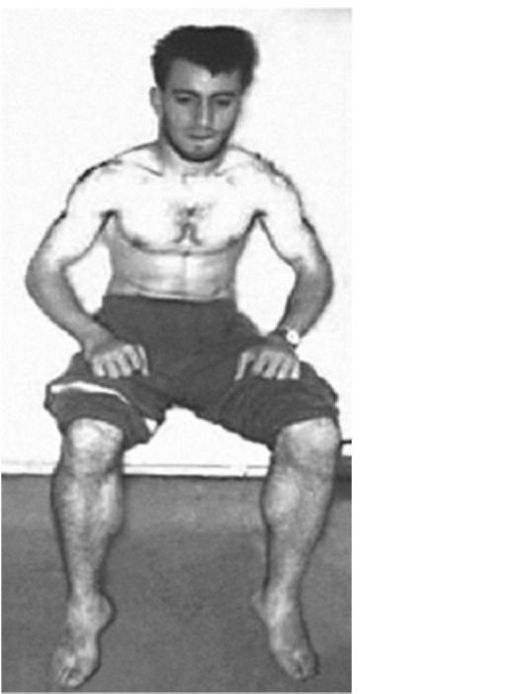
Рис. 6.19. Миотония Томсена у взрослого больного

Рис. 6.20. Миотония Россолимо- Куршмана-Штейнерта-Баттена. Типичный вид больного
при наследовании болезни от матери возрастает в значительно большей степени, чем при наследовании от отца. У матери с 100 тринуклеотидными повторами риск рождения ребенка с 400 повторами выше 90%.
Болезнь представляет собой самый распространенный вид мышечной дистрофии, дебютирующей у взрослых. Встречаемость заболевания - 3-5 случаев на 100 000 населения. Оба пола поражаются с одинаковой частотой. Первые симптомы обычно появляются у подростков. В развернутых стадиях отмечаются миотония, слабость лицевой мускулатуры и дистальных отделов конечностей, катаракты, лобное облысение, множественная эндокринопатия. Атрофии мимических мышц настолько стереотипны по виду, что все больные выглядят похожими: лицо удлиненное и утонченное вследствие слабости височных и жевательных мышц; шея тонкая («лебединая») из-за атрофии грудиноключично-сосцевидных мышц; веки и углы рта опущены, нижняя половина лица провисает, что делает выражение лица печальным. Атрофии конечностей наиболее выражены в дистальных отделах: предплечьях и перонеальных мышцах (рис. 6.20, 6.21). Отмечается дисфагия, обусловленная поражением мышц глотки и гладких мышц пищевода. Сухожильные рефлексы снижаются и исчезают.
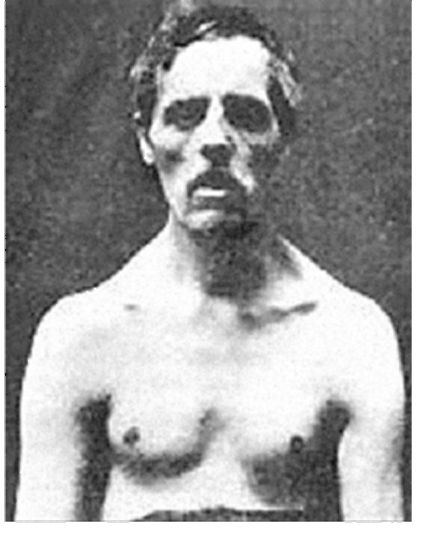
На поздних стадиях заболевания развиваются атрофии мелких мышц кистей. Больные жалуются на напряжение мускулатуры, затруднения при движениях из-за скованности. Миотония нарастает при охлаждении. В целом миотонические феномены не столь выражены, как при врожденной миотонии. Врач может выявить миотонический синдром при расспросе и подтвердить при осмотре. Например, при рукопожатии пациенту с миотонической дистрофией не удается сразу разжать кисть. Экстраневральные симптомы мио- тонической дистрофии - катаракта, лобная алопеция или эндокринные расстройства - возникают еще до клинически значимых симптомов миотонии. Часто регистрируются изменения на ЭКГ. В поздних стадиях может развиваться тяжелая кардиомиопатия с поперечной блокадой, приступами Адамса-Стокса-Морганьи и сердечной недостаточностью. Нарушается перистальтика кишечника, развивается мегаколон. Парез диафрагмы и межреберных мышц приводит к гиповентиляции и рецидивирующим бронхолегочным инфекциям. Эндокринные нарушения включают тестикулярную атрофию, бесплодие у женщин, гиперинсулинизм, сахарный диабет, атрофию надпочечников и нарушение секреции гормона роста. Нередко развиваются гиперсомния и обструктивные апноэ во сне, психические нарушения вплоть до выраженной деменции.
Диагностика базируется на характерных клинических проявлениях и семейном анамнезе. ЭМГ выявляет миотонические феномены, миопатические потенциалы и небольшие признаки денервации. Активность КФК чаще всего соответствует норме. Необходимости в мышечной биопсии для подтверждения диагноза нет. ДНК-анализ обнаруживает увеличение числа тринуклеотидных повторов; он может быть использован для выявления асимптомных пациентов и проведения пренатальной диагностики.
Лечение. Симптомы миотонии ослабевают при назначении препара- тов - мембраностабилизаторов: хинидина, новокаинамида, фенитоина
Рис. 6.21. Миотония Россолимо- Куршмана-Штейнерта-Баттена. «Ле- бединая» шея из-за атрофии грудиноключично-сосцевидной мышцы. Атрофия мышц разгибателей предплечий, перонеальных групп мышц, что приводит к появлению петушиной походки
(дифенина) и карбамазепина (финлепсина). Необходимо учитывать, что миотония сама по себе не инвалидизирует больного и не требует постоянной лекарственной терапии. К сожалению, лечение нарастающей мышечной слабости пока неэффективно. Больные часто относятся к лечению негативно; плохо переносят наркоз, который может осложниться развитием злокачественной гипертермии.
Врожденная миотоническая дистрофия. У матери с миотонической дистрофией вероятность рождения ребенка с врожденной формой болезни составляет 1:4, а если болен отец - 1:12. Основные признаки патологии внутриутробного периода при врожденной форме - снижение двигательной активности плода и многоводие. Преждевременно рождаются 50% детей. Роды могут быть затяжными из-за неадекватного сокращения матки, и часто возникает необходимость наложения акушерских щипцов. У некоторых новорожденных столь грубо страдает функция диафрагмы и межреберных мышц, что они вообще не способны к самостоятельному дыханию. В отсутствие немедленной интубации и ИВЛ многие из них сразу умирают. Наиболее заметные клинические симптомы у новорожденных: лицевая диплегия, при которой рот необычно заострен, а форма верхней губы напоминает перевернутую латинскую букву «V»; генерализованная мышечная гипотония; деформация суставов, варьирующая от двусторонней косолапости до распространенного артрогрипоза; дисфункция желудочно-кишечного тракта в виде пареза мышц желудка, нарушения глотания и аспирации. Слабость наиболее выражена в прок- симальных отделах конечностей. Сухожильные рефлексы отсутствуют. Миотонические феномены не вызываются перкуссией мышц и могут не определяться при ЭМГ. Неонатальная смертность достигает 16% и часто обусловлена кардиомиопатией. У выживших детей мышечная сила, как правило, нарастает, и процессы кормления и дыхания нормализуются в течение 1-го мес жизни.
Отдаленный прогноз неблагоприятен: у всех детей обнаруживаются задержка психического развития и выраженные клинические симптомы миотонической дистрофии. Диагностика требует постановки диагноза миотонической дистрофии у матери, у которой обычно находят множественные клинические признаки заболевания и миотонические ЭМГ-феномены.
Диагноз у матери и ребенка может быть уточнен после проведения амплификации участка ДНК хромосомы 19. Члены семьи входят в группу риска и в дальнейшем проходят генетическое тестирование для установления носительства.
Неотложная помощь новорожденному заключается в немедленной интубации и ИВЛ. Функция желудочно-кишечного тракта нормали- зуется при назначении церукала (метоклопрамида). Тугоподвижность суставов уменьшается при использовании физических методов терапии и иммобилизации.
Врожденная миотония - наследственное заболевание, характеризующееся скованностью и истинной гипертрофией мышц. В 19% семей прослеживается аутосомно-доминантное наследование (болезнь Томсена), реже - аутосомно-рецессивное наследование (болезнь Беккера). Большинство случаев носит спорадический характер. В целом у больных с аутосомно-рецессивной формой заболевание начинается позже и протекает с более тяжелыми миотоническими расстройствами, чем с аутосомно-доминантной. Однако симптомы обеих форм одинаковы, поэтому невозможно сделать вывод о типе наследования исключительно по клиническим критериям (см. рис. 6.18, 6.19).
Патологический ген и доминантной, и рецессивной форм врожденной миотонии картирован на длинном плече хромосомы 7, где расположен ген каналов ионов хлора.
Аутосомно-доминантная форма обычно дебютирует в грудном возрасте с изменения голоса при плаче; ребенок начинает задыхаться, а после плача лицо очень медленно расслабляется. Заболевание протекает легко. В зрелом возрасте миотония может приводить к генерализованной мышечной гипертрофии (атлетизму), но и в детстве мышцы имеют вид «геркулесовых мускулов». Иногда вовлекаются мышцы языка, лица и жевательные мышцы. Скованность мышц не сопровождается болью; она нарастает при пребывании больного на холоде. Выявляются перкуссионные миотонические симптомы. Мышечная масса, сила сокращений и сухожильные рефлексы - в норме. Сразу после отдыха мышцы остаются скованными, а движения - затрудненными. Однако после активизации скованность исчезает, восстанавливается обычный объем движений.
Диагностика. Диагноз подтверждается с помощью ЭМГ-исследования. Частота повторных мышечных осцилляций варьирует от 20 до 80 циклов в секунду от момента первоначального введения иглы в мышцу и до начала произвольного сокращения. Амплитуда и частота потенциалов прибывают и убывают, что сопровождается характерным звуком - «гулом пикирующего бомбардировщика». Признаки мышечной дистрофии отсутствуют. Уровень КФК в норме. В образцах мышечных биоптатов обнаруживается гипертрофия мышечных волокон.
Лечение. Миотония не всегда требует лечения, а лекарства недо- статочно эффективны. Иногда можно уменьшить скованность при назначении фенитоина (дифенина) или препаратов карбамазепина (финлепсина), которые дают в средних противосудорожных дозах. Новокаинамид назначают в начальной дозе 200 мг 2 раза в день, а затем ее постепенно повышают до 400 мг 3 раза в день. Препарат уменьшает мышечную скованность у детей с рецессивной формой болезни. Для некоторых больных эффективен диакарб (ацетазоламид). В тяжелых случаях показан короткий курс кортикостероидов. Полезны антагонисты кальция (нифедипин по 10-20 мг 3 раза в день), а также дизопирамид по 100-200 мг 3 раза в день. Необходимо учитывать, что сукцинилхолин, верошпирон, калий, антигиперлипидемические средства и β-адреноблокаторы способны усиливать миотонический синдром.
Ремиттирующая миотония (миотония, усиливающаяся при избытке калия) - аутосомно-доминантный синдром, связанный с мутацией гена натриевых каналов. Ген картирован на хромосоме 17. Клинические проявления схожи с врожденной миотонией. Дебют мышечной скованности обычно наблюдается после 10 лет и может быть спровоцирован общей анестезией. Миотонические феномены генерализованы, вовлекают туловище, конечности, глазодвигательные мышцы. Тяжесть миотонии день ото дня варьирует и уменьшается при согревании. Ухудшение состояния может наблюдаться после интенсивной физической нагрузки или приема большого количества калия с пищей.
Диагностика. ЭМГ-исследование выявляет миотонические феномены. В мышечных биоптатах патологии нет. Возможен ДНК-анализ мутантного гена, кодирующего α-субъединицу натриевого канала.
Лечение. Скованность при ремиттирующей миотонии может предот- вратить мексилетин - препарат, сходный по структуре с лидокаином; как и при других каналопатиях, может быть эффективен диакарб (ацетазоламид).
6.6. Периодические параличи
Периодические параличи, или пароксизмальная миоплегия, - объединяющий термин для группы каналопатий, редких наслед- ственных заболеваний, которые характеризуются приступами вялого паралича скелетных мышц вследствие патологии ионных каналов. Параличи подразделяют в зависимости от уровня калия в крови: гиперкалиемический (болезнь Гамсторп), гипокалиемический и нормокалиемический. Кроме того, периодический паралич может
быть первичным (генетически детерминированным) или вторичным. Вторичный гипокалиемический периодический паралич обусловлен потерей калия с мочой или его избыточным выведением из желудочнокишечного тракта. «Мочевые» потери калия связаны с первичным гиперальдостеронизмом, интоксикацией солодкой (лакричником), терапией амфотерицином Б и некоторыми почечными тубулярными дефектами. «Желудочно-кишечные» потери калия наиболее часто наблюдаются при тяжелой хронической диарее, длительном зондовом кормлении и гастрофистуле. Калий теряется у подростков с нервной анорексией, которые злоупотребляют диуретиками или искусственно вызывают у себя рвоту, чтобы «похудеть». Гипокалиемический периодический паралич осложняет тиреотоксикоз. Вторичный гиперкалиемический периодический паралич может быть обусловлен почечной или надпочечниковой недостаточностью.
Семейный гиперкалиемический паралич наследуется по аутосомнодоминантному типу с высокой пенетрантностью. Мутация расположена в гене натриевых каналов.
Клиническая картина. Дебют приступов мышечной слабости относится к раннему детскому и даже грудному возрасту. Приступы слабости возникают после интенсивной физической нагрузки. Перед приступом бывают чувствительные нарушения - парестезии в области лица, верхних и нижних конечностей, ощущение тяжести в спине. Изредка больной может замедлить развитие паралича ходьбой или переходом с места на место. У детей грудного и раннего возраста приступы выражаются внезапной потерей мышечного тонуса: они падают и не могут двигаться. У детей старшего возраста и взрослых могут наблюдаться как приступы средней тяжести (продолжаются менее часа и не приводят к глубокому параличу), так и тяжелые приступы (до нескольких часов). После нескольких тяжелых атак может оставаться некоторая остаточная мышечная слабость. Симптомы миотонии у больных с гиперкалиемическим параличом выражены умеренно и могут усиливаться при охлаждении. Характерна миотония век, языка, мышц предплечья и большого пальца.
Диагностика. Во время приступа содержание калия в крови обычно превышает 5 ммоль/л. Пероральный прием хлорида калия сразу после физической нагрузки немедленно провоцирует приступ слабости, на протяжении которого мышцы не реагируют на электрические стимулы.
Лечение. Острые приступы редко требуют лечения, поскольку они кратковременны. При развернутом приступе может помочь внутривен-
ное вливание 40% раствора глюкозы (до 40 мл) или 10% раствора глюконата кальция (до 20 мл). Ежедневный прием диакарба (ацетазоламида) предотвращает повторные приступы, механизм превентивного действия этого препарата при гиперкалиемическом и гипокалиемическом параличе неизвестен. Следует избегать приема пищи, богатой калием, увеличить в дневном рационе количество углеводов и поваренной соли.
Семейный гипокалиемический паралич наследуется по аутосомнодоминантному типу. Пенетрантность гена у женщин снижена. Мутация находится на длинном плече хромосомы 7, в гене кальциевых каналов. У 60% больных симптомы возникают до 16 лет, у остальных - до 20 лет жизни. Вначале приступы слабости нечастые, но затем бывают до нескольких раз в неделю. Приступы провоцируют: отдых после физической нагрузки (часто приступы наблюдаются ранним утром), обильный прием углеводистой пищи, избыток поваренной соли в рационе, эмоциональный стресс, прием алкоголя, переохлаждение; у женщин - менструации. До и во время приступа у больного могут отмечаться жажда и олигурия, болезненные ощущения в проксимальных группах мышц, затем развивается общая слабость. Иногда наблюдается тотальный паралич, при котором больной не в состоянии даже поднять голову. Слабость лицевых мышц бывает редко, движения глаз всегда сохранены. Дыхательная недостаточность не развивается. Большинство приступов длится от 6 до 12 ч, а некоторые - в течение всего дня (так называемый миоплегический статус). Мышечная сила быстро восстанавливается, но после нескольких тяжелых приступов могут отмечаться усталость, похудание, особенно проксимальных отделов конечностей, угнетение сухожильных рефлексов. Типичны вегетативные расстройства: гиперемия кожи, гипергидроз, лабильность пульса и артериального давления. Вне приступов мышечной слабости у больных отсутствуют симптомы нервно-мышечной патологии.
Диагностика. Во время приступа уровень калия в крови может снизиться до 1,5 ммоль/л, чему соответствуют изменения ЭКГ: брадикардия, уплощение зубца Т, увеличение интервалов Р-Q и Q-Т. Мышцы не сокращаются в ответ на электрические стимулы. С диагностической целью приступ можно спровоцировать приемом глюкозы в дозе 2 г/кг и одновременным подкожным введением 10-20 ЕД инсулина: приступ паралича развивается через 2-3 ч.
Лечение. Острые приступы у больных с адекватной функцией почек купируют повторными приемами калия в дозе от 5 до 10 г.
Такая же доза, принимаемая ежедневно, рекомендуется для профилактики их возникновения. У детей младшего возраста доза меньше. Ежедневный прием диакарба (ацетазоламида) оказывает благоприят- ное действие, предупреждая приступы во многих случаях. Он малотоксичен и обычно хорошо переносится даже при длительном применении. Следует снизить калорийность суточного рациона за счет углеводов и уменьшить количество поваренной соли. В то же время показаны продукты, богатые калием: сухофрукты, курага, чернослив, молочные продукты, картофель.
Семейный нормокалиемический паралич. В некоторых семьях наблюдаются случаи аутосомно-доминантного периодического паралича при нормальном уровне калия в крови. Это вариант гиперкалиемического периодического паралича с нарушением притока калия в кровь, когда невозможно оценить его истинное содержание в тканях. Миоплегия длится от нескольких дней до 2-3 нед. Темп нарастания и уменьшения мышечной слабости обычно медленный. Сухожильные рефлексы во время приступов исчезают. У части больных наблюдается гипертрофия отдельных мышечных групп. Приступы провоцируются отдыхом после интенсивной физической нагрузки, приемом алкоголя, охлаждением. Прием хлорида калия может спровоцировать приступ паралича, тогда как употребление 8-10 г поваренной соли ежедневно позволяет их избежать.
6.7. Миастения
Миастения (myastenia gravis) - аутоиммунное нервно-мышечное заболевание, клинически характеризующееся патологической слабостью и утомляемостью произвольной мускулатуры и связанное с повреждением ацетилхолиновых рецепторов (АХ-Р) постсинаптической мембраны поперечнополосатых мышц специфическими ком- плементфиксирующими антителами (АТ).
Распространенность миастении составляет 0,5-5 случаев на 100 000 населения во всех популяциях. Дети и подростки до 17 лет составляют 9-15% числа больных миастенией. Средний возраст начала болезни - 7,2 года. Дебют миастении возможен в любом возрасте. Описаны врожденные формы. Женщины болеют в 3 раза чаще, чем мужчины.
Этиология. Мультифакториальное заболевание, при котором определенное значение имеет наследственная предрасположенность, обусловленная иммунологическим дефектом и связанная с анти-
генами гистосовместимости B8 системы HLA. Причиной миастении могут быть вирусное поражение вилочковой железы, вследствие чего она начинает продуцировать Т-лимфоциты с измененными мембранными структурами; опухоль тимуса; в редких случаях - первичное поражение головного мозга различной этиологии.
Основой патогенеза миастении является аутоиммунная реакция на ацетилхолинэстеразные рецепторы (АХ-Р) скелетных мышц. Уровень антител к АХ-Р в крови больных коррелирует со степенью тяжести болезни. Антитела к АХ-Р блокируют нервно-мышечную проводимость, поскольку разрушают АХ, уменьшают скорость его восстановления, необратимо изменяя рецепторы постсинаптической мембраны.
Патологическая анатомия. Происходят дистрофические изменения терминалей аксонов, синаптических щелей и постсинаптических структур, в них откладываются иммуноглобулины и комплемент. В мышцах наблюдается умеренная дегенеративная атрофия, реже некроз волокон в сочетании с нерезко выраженной лимфоидной инфильтрацией и плазморрагией. У 70-90% больных выявляется патология вилочковой железы (гиперплазия зародышевых фолликулов, лимфоэпителиальные тимомы). В редких случаях отмечаются миокардит, тиреоидит, очаговые скопления лимфоцитов в различных органах.
Клиническая классификация миастении (по Б.М. Гехту).
1. Степень генерализации двигательных расстройств:
1) генерализованная;
2) локальная:
а) глазная,
б) бульбарная,
в) скелетная.
2. Степень тяжести двигательных нарушений:
1) легкая;
2) средняя;
3) тяжелая.
3. Течение миастенического процесса:
1) ремиттирующее (миастенические эпизоды);
2) непрогрессирующее (миастеническое состояние);
3) прогрессирующее;
4) злокачественное.
4. Степень компенсации двигательных расстройств под влиянием антихолинэстеразных препаратов:
1) полная (вплоть до восстановления работоспособности);
2) неполная (восстанавливается способность к самообслуживанию);
3) плохая (больные нуждаются в постороннем уходе). Клиническая картина. Миастения характеризуется патологической
утомляемостью и слабостью поперечнополосатых мышц. Больным трудно подниматься по лестнице, ходить, долго находиться в одной позе, носить тяжести.
Наиболее часто поражаются глазодвигательные, мимические, жевательные мышцы, а также мышцы глотки, гортани, языка. Поражение наружных мышц глаза во время первого осмотра выявляется у 40-50% больных, а по мере развития болезни - у 90-95%. Птоз может быть односторонним, причем возникает то с одной, то с другой стороны. Утром и после отдыха птоз меньше, нарастает при общей или зрительной нагрузке, к вечеру. При осмотре спровоцировать усиление птоза можно, попросив пациента несколько раз зажмуриться или присесть. Глазодвигательные нарушения асимметричны, изменчивы при нагрузке и не соответствуют зонам иннервации глазодвигательных нервов. За счет мышечной слабости возникает нистагм в крайних отведениях. Диплопия усиливается при зрительной и физической нагрузке, ярком свете, во второй половине дня (особенно при просмотре телевизора), более выражена при взгляде вдаль, уменьшается после отдыха с закрытыми глазами и по утрам (рис. 6.22).
Слабость жевательных и височных мышц приводит к утомлению при жевании иногда до отвисания нижней челюсти, больные во время еды поддерживают челюсть и помогают себе при жевании рукой. Важным сим- птомом является слабость мышц лица. Она более выражена в верхней половине лица (в круговых мышцах глаз), усиливается при повторном зажмуривании и общей физической нагрузке. Пациенту трудно надуть щеки, возникает «поперечная» улыбка вследствие слабости круговой мышцы рта. Также отмечается слабость жевательных и височных мышц.
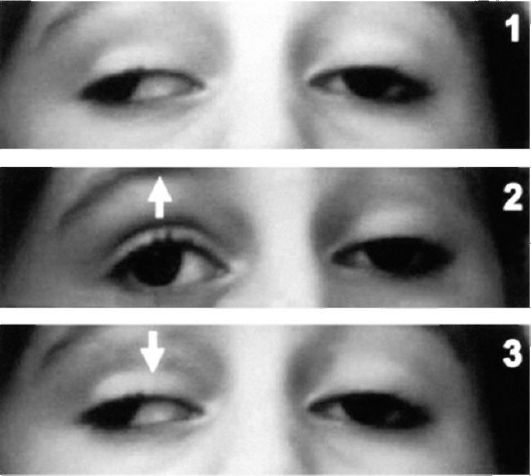
Рис. 6.22. Слабость глазных мышц при миастении
Поражение бульбарных мышц (мягкого нёба, глотки и верхних мышц пищевода), приводящее к дисфагии и дизартрии, развивает- ся у 40% больных. Оно усиливается при речевой, общей физической нагрузке, во время еды и уменьшается после отдыха. Нарушается глотание (пациент поперхивается при еде, жидкая пища попадает в носовые ходы). Речь становится гнусавой, может отмечаться охриплость голоса или нарушения модуляции, похожие на заикание. При тяжелой дизартрии больной не может глотать и говорить.
Слабость мышц шеи и туловища больше характерна для больных пожилого возраста. Слабость мышц спины проявляется нарушением осанки. За счет слабости задней группы мышц шеи возникает затруднение при подъеме головы в положении на спине или при разгибании шеи в вертикальном положении. Если миастения дебютирует со слабости мышц туловища, в дальнейшем развиваются бульбарные и дыхательные нарушения.
Жалобы на одышку при вдохе обусловлены слабостью диафрагмы или межреберных мышц. Ослабление кашлевого толчка приводит к скоплению густой мокроты, вязкой слюны, которую невозможно сплюнуть или проглотить.
Ослаблены мышцы конечностей, особенно проксимальных, шеи, туловища. При осмотре выявляются мышечные атрофии, снижение мышечного тонуса, лабильность сухожильных и надкостничных рефлексов. Слабость мышц конечностей может быть изолированной (без других симптомов миастении) или сочетаться со слабостью других групп мышц. Типична слабость проксимальных мышц-разгибателей. Наиболее часто поражаются дельтовидная мышца, трехглавая мышца плеча, подвздошная мышца.
Кроме двигательных расстройств, миастения сопровождается различными вегетативными и эндокринными нарушениями (гипо- и гипертиреоз, гипокортицизм и др.). Миастению характеризуют динамичность мышечной слабости в течение суток, усиление ее после нагрузки, обратимость или уменьшение слабости после отдыха. Ухудшение состояния провоцируют физическая нагрузка, отрицательные эмоции, менструация, инфекции, повышение температуры окружающей среды, а улучшают - ночной сон, отдых. Патогномонично уменьшение утомляемости после введения антихолинэстеразных препаратов (АХП).
Течение болезни чаще всего прогрессирующее, с ремиссиями или прогредиентное без ремиссий. При злокачественном течении буль- барные и дыхательные расстройства развиваются в течение первых недель заболевания. Миастения чаще дебютирует после ОРВИ или
стресса, одним симптомом (преходящий птоз, бульбарный парез и др.). Состояние больных с миастенией могут осложнять миастенические кризы или холинергические кризы.
Миастенический криз развивается вследствие декомпенсации миастении или недостаточной дозировки АХП; может провоцироваться бронхолегочной инфекцией. При этом происходит резкое ухудшение состояния с нарушением витальных функций. Дифференцировать миастенический криз от других тяжелых состояний, сопровождающихся респираторными расстройствами, можно по наличию асимметричного наружного офтальмопареза, птоза, бульбарного синдрома, гипомимии, слабости мышц конечностей и шеи, уменьшающихся в ответ на введение АХЭ препаратов (табл. 10).
Холинергический криз развивается при избыточной дозе АХЭ препаратов.
Таблица 10. Дифференциальная диагностика миастенического и холинергического кризов
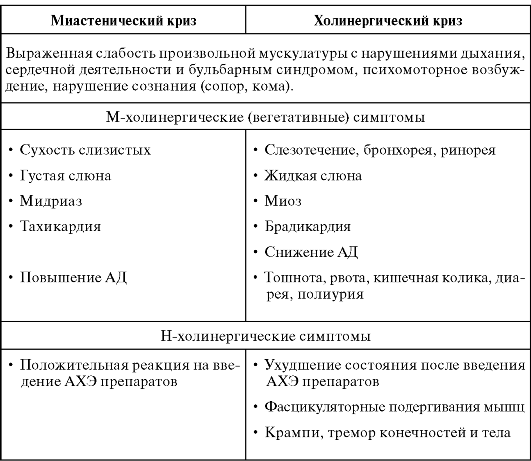
Смешанные (миастенический + холинергический) кризы встречаются у больных миастенией при неправильном приеме и/или изначально узком диапазоне терапевтических доз АХЭП, а также на фоне состояний, вызывающих общую или мышечную слабость различного генеза (интеркуррентные инфекции, соматические, гормональные нарушения, прием препаратов, влияющих на сократительную функцию произвольных мышц, и др.).
Прогноз зависит от клинической формы и проводимого лечения. Возможны практические выздоровления (примерно у 1 / 3 больных), значительное улучшение, инвалидность, летальные исходы, особенно при тимоме. Основными симптомами, угрожающими жизни больного, являются слабость мышц гортани и дыхательных мышц. Причины смерти при миастении: дыхательная недостаточность, аспирационная пневмония, побочные эффекты кортикостероидов и цитотоксических препаратов.
Диагностика включает сбор анамнеза, клинический осмотр, пробу с АХЭ-препаратами (прозерином, тензилоном, калимином), электромиографию, иммунологическое исследование, исследование вилочковой железы, морфологическое исследование мышечного биоптата, динамическое наблюдение.
Клинический осмотр включает исследование общего неврологического статуса и оценку силы произвольных мышц лица, шеи, туловища и конечностей до и после нагрузки. Мышечная сила оценивается от 0 до 5 баллов, где 0 - отсутствие силы, 5 - нормальная сила с учетом возраста и пола. Также выявляют синдром патологической мышечной утомляемости (нарастание симптомов после нагрузки) при отсутствии симптомов поражения центральной нервной системы.
Диагностические критерии
1. Птоз (односторонний, двусторонний, асимметричный, симметричный): появление или усиление птоза после долгого смотрения вверх или после быстрого многократного открывания или закрывания глаз.
2. Слабость жевательных мышц:
• недостаточное сопротивление насильственному закрытию нижней челюсти;
• пальпация височных мышц при жевании обнаруживает их слабое сокращение;
• больные не в состоянии плотно сомкнуть веки или оказать сопротивление пассивному открыванию глаз;
• больные не могут надуть щеки при надавливании на них.
3. Слабость мышц гортани и нёба выявляется, если:
• нёбо малоподвижно, рвотный рефлекс снижен или отсутствует;
• трудно глотать жидкую пищу.
4. Слабость мышц языка выявляется при надавливании языком на палец врача через щеку.
5. При выраженной слабости мышц шеи «голова свешивается».
6. Прозериновая проба с оценкой силы и утомляемости мышц проводится до подкожного введения 0,05% раствора прозерина в разовой возрастной дозировке и через 30-40 мин после него. Проба считается положительной, если мышечная сила нарастает. Различают:
Резкоположительную пробу, когда исчезают все миастенические симптомы;
Положительную пробу - остаются только отдельные симптомы;
Слабоположительную пробу, при которой уменьшается выраженность миастенических симптомов;
Сомнительную прозериновую пробу - степень выраженности проявлений миастении изменяется незначительно;
Отрицательную прозериновую пробу - клиническая симптоматика не изменяется после введения прозерина.
Подтверждением диагноза миастении считается наличие одного из первых трех вариантов прозериновой пробы.
Проводят ЭМГ наиболее ослабленных мышц для выявления особенностей нарушений нервно-мышечной передачи (мышца, отводящая мизинец, в двубрюшной мышце дна рта). Исследование проводят на фоне отмены АХЭП в течение суток, сразу после физической нагрузки и через 2 мин после нагрузки. Большое значение имеет обратимость ЭМГ-феноменов на фоне АХЭП - нарастание амплитуды М-ответа. При электромиографии отмечается уменьшение амплитуды второго потенциала действия мышц (в норме оба потенциала равны) в ответ на стимуляцию нерва спаренными импульсами с промежутком 0,1-0,7 с. При миастении снижение амплитуды потенциалов при постоянной стимуляции нерва сменяется фазой плато или повышением амплитуды, а при других заболеваниях происходит неуклонное снижение амплитуды ответа. При регистрации активности отдельных мышечных волокон часто выявляются характерные признаки поражения нервно-мышечных синапсов. В 95% случаев на ЭМГ обнаруживают патогномоничные изменения.
Для исключения опухоли или гиперплазии вилочковой железы, которая развивается у 75% больных с миастенией, проводят компьютерную томографию средостения, радионуклидное сканирование.
Иммунологическое исследование выявляет наличие антител к холинорецепторам у 50% больных с глазной формой миастении и у 80-90% больных с генерализованной формой. При тимоме также выявляются антигены к скелетным мышцам.
Иммунологическое исследование (ИФА, РИА) - количественный метод определения антител к АХР в сыворотке крови больных миастенией, который позволяет с вероятностью до 80% подтвердить диагноз.
Дифференциальный диагноз проводят с состояниями, ведущим симптомом которых является мышечная слабость:
• миастенические синдромы (ботулизм, отравление антибиотиками из группы аминогликозидов, болезнь Иценко-Кушинга, болезнь Аддисона, гипо- и гипертиреоз, полиомиозит);
• рассеянный склероз, нейроинфекции (энцефалит, полиневропатии, энцефаломиелополирадикулоневриты): у больных офтальмопарез сопровождается гипорефлексией, атаксией, нарушением чувствительности, изменением ЦСЖ;
• боковый амиотрофический склероз: слабость постоянна, отмечаются атрофия, фасцикуляции, повышение сухожильных рефлексов, симптом Бабинского;
• глазная форма миопатии: характерны птоз и симметричное ограничение движений глазных яблок; легкая слабость мышц глотки, шеи, конечностей и лица;
• митохондриальные миопатии;
• нейроэндокринные синдромы;
• другие заболевания ЦНС (опухоли, сосудистые заболевания головного и спинного мозга): характерны нарушения рефлексов, проводниковые расстройства;
• астеноневротические реакции, синдром хронической усталости и др.
Лечение. Общие принципы:
1. При генерализованной форме больного госпитализируют и ограничивают физическую нагрузку до подбора антихолинес- теразной терапии.
2. Противопоказаны средства, блокирующие нервно-мышечную передачу, а также оказывающие угнетающее действие на ЦНС,
и особенно - на дыхательный центр (хинин, хинидин, пропранолол, лидокаин, аминогликозиды, полимиксин, морфин, барбитураты, транквилизаторы). 3. Задачи лечения зависят от тяжести заболевания. Антихолинестеразные препараты (АХЭП) - препараты выбора при миастении, тормозят разрушение ацетилхолина и способствуют его накоплению в синаптической щели, воздействуя на холинергические синапсы, не проникают через ГЭБ (табл. 11). Побочные эффекты обусловлены одновременным влиянием на вегетативные холинергические синапсы и зависят от дозы и тонуса ВНС. Их можно уменьшить, если принимать ингибиторы АХЭ чаще, но в меньших дозах и во время еды, что замедляет всасывание. В некоторых ситуациях (менструация, инфекции, ремиссия) чувствительность к АХЭП повышается, и их дозу уменьшают. Больных обучают регулировать дозу самостоятельно. Относительными противопоказаниями к применению АХЭП являются бронхиальная астма, тяжелый атеросклероз, ИБС, эпилепсия.
Таблица 11. Антихолинергические препараты
Препараты | Время действия | Области применения |
Прозерин (неостигмин) | Начало действия через 20-40 мин, дли- тельность 2-4 ч | Применяется преимущественно для проведения медикаментозных проб и в острых состояниях |
Калимин 60 Н, калимин-форте (пиридостигми- на бромид) | Начало через 45 мин, действует 4-8 ч Интервал между приемами 5-5,5 ч. | Наиболее широко применяется, хорошо переносится, эффективен при всех формах, в том числе бульбарных. Калимин форте (парентеральный) - при нарушении витальных функций и при стойком бульбарном параличе. При переводе больных на парентеральное введение препаратов учитывается, что 1 таблетка калимина (60 мг) равноценна 1 мл 0,05% раствора прозерина |
Вспомогательная терапия: препараты калия (пролонгируют действие АХЭП); диета, богатая калием (печеный картофель, курага, бананы и др.); калийсберегающие препараты (верошпирон); хлорид калия 3,0 г/сут в растворах, порошках, таблетках с целью предупреждения передозировки АХЭП; препараты кальция; тонизирующие средства (экстракты элеутерококка, родиолы, левзеи, пантокрин); поливитамины, эуфиллин (блокатор фосфодиэстеразы, увеличивающий содержание цАМФ в пресинаптической мембране), анаболики (рибоксин, ретаболил).
Патогенетическая терапия - тимэктомия. Эффективность - 70-90%, возможны ремиссии. Показаниями к оперативному лечению являются:
а) злокачественные формы миастении;
б) прогрессирующая форма миастении;
в) миастеническое состояние в зависимости от степени выраженности дефекта.
Противопоказания к тимэктомии:
а) тяжелые декомпенсированные соматические заболевания;
б) пожилой возраст.
Предоперационная подготовка включает общеукрепляющую терапию, плазмаферез, по показаниям - глюкокортикоиды, лучевую терапию (противопоказана детям и подросткам).
Глюкокортикоиды (преднизолон, дексаметазон) показаны при неэф- фективности других методов. Их назначают ежедневно или через день, по 60-150 мг/сут (1-1,5 мг/кг/сут) утром, сразу после завтрака, через день; при выраженном обострении ежедневно (до компенсации витальных нарушений), через 5-7 дней (до терапевтического эффекта) переходят на схему через день. Поддерживающая доза - через день 20-30 мг в сутки, принимается в течение нескольких месяцев. Примерно у 75% больных кортикостероидная терапия приводит к существенному улучшению. После стабильного улучшения дозу кортикостероидов медленно (в течение нескольких месяцев) снижают до поддерживающей (5-15 мг ежедневно или 10-30 мг через день). Иногда удается полностью отменить кортикостероиды. Чтобы избежать первоначального ухудшения, лечение можно начинать с низких доз (25 мг преднизолона через день) с постепенным увеличением дозы на 12,5 мг в каждый третий прием, пока суточная доза не достигнет 100 мг или не будет получен хороший эффект. Улучшение отмечается спустя 6-7 нед лечения. Дозу в этих случаях начинают снижать не раньше чем через 3 мес после первого приема.
Плазмаферез назначают при обострениях, миастенических кризах, предоперационной подготовке, неэффективности кортикостероидной терапии. Проводится 3-5 сеансов через день, затем 2-3 раза в неделю. Плазмаферез проводят с заменой плазмы или использованием белков-заменителей. Гемосорбция и энтеросорбция проводятся у больных с генерализованной формой миастении с целью выведения антител, а при смешанных кризах и неэффективности массивной медикаментозной терапии - с целью детоксикации.
Цитостатики (азатиоприн, циклофосфан и циклоспорин) назначают под контролем анализов крови. Препараты иммуноглобулина G (в/в 0,4 г/кг/сут ежедневно в течение 5 дней; или 3-5 г на курс) эффективны при интеркуррентных инфекциях, во время миастенического или смешанного криза.
Лечение кризов направлено на компенсацию витальных нарушений, купирование обострения и устранение метаболических нарушений. При лечении миастенического криза вводят парентерально АХЭП (калимин-форте по 1-1,5 мл в/в или в/м каждые 4-5 ч или прозерин по 1,5-2 мл каждые 3 ч). ИВЛ с полной отменой АХЭП, назначение иммуносупрессивной терапии на фоне антибактериальных пре- паратов проводят с целью профилактики интеркуррентных инфекций. Отключение от аппарата проводят только после 30 мин самостоятельного дыхания, при компенсации дыхательных расстройств и на фоне калимина-форте на 5-6 ч. Большие дозы глюкокортикоидов назначают по альтернирующей схеме (пульс-терапия - 1000-2000 мг в/в капельно через день) с последующим переводом на пероральный прим. Также стабилизируют сердечно-легочную деятельность. Проводят плазмафе- рез, внутривенные инфузии нормального человеческого иммуноглобулина. Холинергический криз купируют атропином, реактиваторами холинэстеразы (дипироксим); применяют дезинтоксикацию.
